题目内容
CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
考点:热化学方程式,有关反应热的计算
专题:化学反应中的能量变化
分析:根据题干描述书写化学方程式,注意焓变与物质的量的对应关系、注明各物质的状态.
解答:
解:该反应每消耗1mol CuCl(s),放热44.4kJ,消耗4mol CuCl(s),则放热44.4kJ×4=177.6kJ,根据热化学方程式的书写方法,可以写出该反应的热化学方程式为4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol,
故答案为:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol.
故答案为:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol.
点评:本题考查了热化学方程式的书写,应注意在书写热化学方程式时,焓变与物质的量的对应关系、并注明各物质的状态.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
右图为元素周期表短周期的一部分.关A~F六种元素的叙述正确的是( )
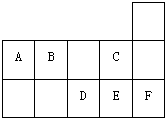

| A、A、B、D、E四种元素所形成的最高价含氧酸中D酸性最强 |
| B、形成的简单阴离子半径:C>B>D>E |
| C、D、E、F形成的单质都是双原子分子 |
| D、A与E形成的分子是一种常见有机溶剂 |
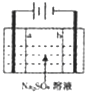 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
根据碘与氢气反应的热化学方程式(碘为气态或固态),下列判断正确的是( )
(ⅰ) I2(?)+H2(g)?2HI(g)+9.48kJ (ⅱ) I2(?)+H2(g)?2HI(g)-26.48kJ.
(ⅰ) I2(?)+H2(g)?2HI(g)+9.48kJ (ⅱ) I2(?)+H2(g)?2HI(g)-26.48kJ.
| A、ⅰ中碘为气态,ⅱ中碘为固态 |
| B、反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
| C、1 mol I2(g)中通入1 mol H2(g),反应放热9.48 kJ |
| D、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
从海带灰中可以提取碘,主要反应为:Cl2+2I-═I2+2Cl-,下列说法不正确的是( )
| A、该反应属于置换反应 |
| B、反应中I-离子发生还原反应 |
| C、Cl2的氧化性比I2的氧化性强 |
| D、生成1mol I2转移2mol e- |
 甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.
甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.