题目内容
关于溶液中微粒的浓度,下列说法正确的是( )
| A、0.1mol?L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | ||
| B、等浓度等体积的NaHSO3溶液与NaClO溶液混合后:c(Na+)+c(H+)=c(HSO3-)+c(ClO-)+2c(SO32-)+c(OH-) | ||
C、等浓度等体积的NaHCO3溶液与NaCl溶液混合后:
| ||
| D、标况下,将2.24L SO2气体通入到100ml 1mol?L-1的NaOH溶液中,完全反应后溶液呈酸性,则该溶液中:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、铵根离子存在微弱的水解,盐直接电离出的离子浓度大于水解的到的离子浓度,据此回答;
B、次氯酸根离子具有氧化性,能将亚硫酸氢钠离子氧化为硫酸根离子;
C、等浓度等体积的NaHCO3溶液与NaCl溶液混合后,溶液中存在物料守恒;
D、标况下,将2.24L SO2气体通入到100ml 1mol?L-1的NaOH溶液中,完全反应后溶液为亚硫酸氢钠溶液,显示酸性,说明亚硫酸氢根离子水解程度小于电离程度.
B、次氯酸根离子具有氧化性,能将亚硫酸氢钠离子氧化为硫酸根离子;
C、等浓度等体积的NaHCO3溶液与NaCl溶液混合后,溶液中存在物料守恒;
D、标况下,将2.24L SO2气体通入到100ml 1mol?L-1的NaOH溶液中,完全反应后溶液为亚硫酸氢钠溶液,显示酸性,说明亚硫酸氢根离子水解程度小于电离程度.
解答:
解:A、(NH4)2SO4溶液中,铵根离子存在微弱的水解,盐直接电离出的离子浓度大于水解的到的离子浓度,c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B、次氯酸根离子具有氧化性,能将亚硫酸钠离子氧化为硫酸根离子,溶液混合后得到等量的硫酸氢钠和氯化钠溶液,存在电荷守恒::c(Na+)+c(H+)=c(Cl-)+2c(SO42-)+c(OH-),故B错误;
C、等浓度等体积的NaHCO3溶液与NaCl溶液混合后,碳酸氢根离子水解、电离导致存在不同的形态,溶液中存在物料守恒:
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C正确;
D、标况下,将2.24L SO2气体通入到100ml 1mol?L-1的NaOH溶液中,完全反应后溶液为亚硫酸氢钠溶液,显示酸性,说明亚硫酸氢根离子水解程度小于电离程度,所以c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故D错误.
故选C.
B、次氯酸根离子具有氧化性,能将亚硫酸钠离子氧化为硫酸根离子,溶液混合后得到等量的硫酸氢钠和氯化钠溶液,存在电荷守恒::c(Na+)+c(H+)=c(Cl-)+2c(SO42-)+c(OH-),故B错误;
C、等浓度等体积的NaHCO3溶液与NaCl溶液混合后,碳酸氢根离子水解、电离导致存在不同的形态,溶液中存在物料守恒:
| 1 |
| 2 |
D、标况下,将2.24L SO2气体通入到100ml 1mol?L-1的NaOH溶液中,完全反应后溶液为亚硫酸氢钠溶液,显示酸性,说明亚硫酸氢根离子水解程度小于电离程度,所以c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故D错误.
故选C.
点评:本题考查了弱电解质的电离、盐的水解、溶液中离子浓度大小比较等,题目难度中等,注意把握溶液中电荷守恒、物料守恒的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作中,正确的是( )
| A、在CuSO4溶液中滴入少量NaOH溶液,来配制新制Cu(OH)2 |
| B、在稀氨水中逐渐加入稀的硝酸银溶液来配制银氨溶液 |
| C、除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 |
| D、溴乙烷在氢氧化钠存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在 |
 25℃时,在25mL 0.1mol?L-1的NaOH 溶液中,逐滴加入0.2mol?L-1的CH3COOH 溶液,溶液的pH 与醋酸溶液体积关系如图.下列分析正确的是( )
25℃时,在25mL 0.1mol?L-1的NaOH 溶液中,逐滴加入0.2mol?L-1的CH3COOH 溶液,溶液的pH 与醋酸溶液体积关系如图.下列分析正确的是( )| A、B 点的横坐标a=12.5 |
| B、C 点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、D 点时溶液中有:2c(Na+)=c(CH3COO-)+c(CH3COOH) |
| D、曲线上A、B 间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
右图为元素周期表短周期的一部分.关A~F六种元素的叙述正确的是( )
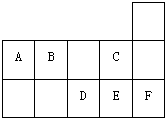

| A、A、B、D、E四种元素所形成的最高价含氧酸中D酸性最强 |
| B、形成的简单阴离子半径:C>B>D>E |
| C、D、E、F形成的单质都是双原子分子 |
| D、A与E形成的分子是一种常见有机溶剂 |
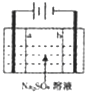 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
从海带灰中可以提取碘,主要反应为:Cl2+2I-═I2+2Cl-,下列说法不正确的是( )
| A、该反应属于置换反应 |
| B、反应中I-离子发生还原反应 |
| C、Cl2的氧化性比I2的氧化性强 |
| D、生成1mol I2转移2mol e- |
 甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.
甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.