题目内容
Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图: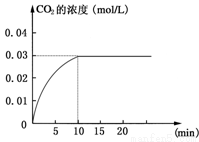
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列关于物质的性质和用途表述没有直接联系的是( )
| 选项 | 性质 | 用途 |
| A | 钠和钾的合金能导电 | 原子反应堆的导热剂 |
| B | 二氧化硫具有漂白性 | 漂白纸浆 |
| C | 镁燃饶时发出耀眼的强光 | 制作照明灯 |
| D | Al(OH)3加热易分解 | 塑料的阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
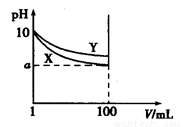
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
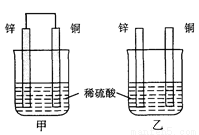
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
3.下列检验或实验操作正确的是( )
| A. | 加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有Cl- | |
| B. | 加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO42- | |
| C. | 向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl- | |
| D. | 已知丙酮是无色液体,不溶于水,密度小于水,分离水和丙酮的最合理方法为蒸馏或蒸发 |