题目内容
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
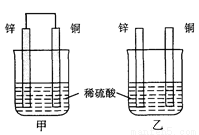
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.某同学对铁的氧化物产生浓厚兴趣,查阅资料后得到以下信息:
在空气中把铁灼烧至500℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400℃)时,可失去氧,又得到Fe3O4.即: 下列说法正确的是( )
下列说法正确的是( )
在空气中把铁灼烧至500℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400℃)时,可失去氧,又得到Fe3O4.即:
 下列说法正确的是( )
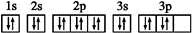
下列说法正确的是( )| A. | FeO、Fe2O3和Fe3O4均为黑色固体 | |
| B. | 反应②③互为可逆反应 | |
| C. | 热稳定性顺序为:FeO>Fe2O3>Fe3O4 | |
| D. | 四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式则化学式可写为FeO•Fe2O3,若视四氧化三铁为一种盐其化学式可写为Fe(FeO2)2 |


 CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图: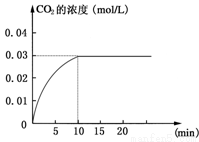
 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。 R(g)+S(s)在恒温、恒容下已达到平衡的是( )
R(g)+S(s)在恒温、恒容下已达到平衡的是( )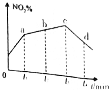 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应: