题目内容
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为
A.直线形 sp杂化 
 B.三角形 sp2杂化
B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列关于粒子结构的描述不正确的是( )
| A. | H2S和NH3均是价电子总数为8的极性分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CH2Cl2和CCl4均是四面体构型的非极性分子 | |
| D. | SO2和SO3来化轨道类型均为sp2杂化,空间构型分别为V形、平面三角形 |
11.(l)由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向正极(填“正极”或“负极’).负极的电极反应式是Zn-2e-=Zn2+,标准状况下生成2.24L气体.
| 装置 | 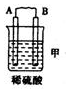 | 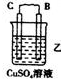 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向正极(填“正极”或“负极’).负极的电极反应式是Zn-2e-=Zn2+,标准状况下生成2.24L气体.


 下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·m
2NH3(g) △H=-38.6kJ·m ol-1
ol-1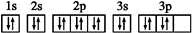
 CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图: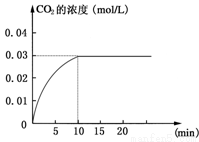
 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。