题目内容
9.已知反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的是( )| A. | 达平衡后降低温度,混合气体平均相对分子质量减小 | |
| B. | 使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率 | |
| C. | 达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变 | |
| D. | 达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动 |
分析 A、正反应是放热反应,所以降低温度,平衡正向移动;
B、使用催化剂平衡不动,所以A2的转化率不变;
C、达平衡后升高温度平衡逆向移动、增大压强平衡正向移动,有可能每一组分的百分含量都不改变,但平衡常数是温度的函数;
D、减小压强平衡逆向移动.
解答 解:A、正反应是放热反应,所以降低温度,平衡正向移动,气体的质量不变,但物质的量减小,所以混合气体平均相对分子质量增大,故A错误;
B、使用催化剂,反应速率加快,但平衡不动,所以A2的转化率不变,故B错误;
C、达平衡后升高温度平衡逆向移动、增大压强平衡正向移动,有可能每一组分的百分含量都不改变,但平衡常数是温度的函数,所以温度升高平衡常数减小,故C正确;
D、减小压强平衡逆向移动,而不是正向移动,故D错误;
故选:C.
点评 本题考查较为综合,涉及反应热、平衡常数以及平衡移动问题,题目难度中等,做题时注意把握平衡移动的影响因素和平衡移动方向的判断.

练习册系列答案
相关题目
20. 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )| A. | 该反应的平衡常数表达式为:K=$\frac{{C}_{(C)}}{{{C}^{2}}_{(A)}•{C}_{(B)}}$ | |
| B. | 0~4 min时,A的平均反应速率为0.01 mol/(L•min) | |
| C. | 由T1向T2变化时,v正>v逆 | |
| D. | 平衡后升高温度,K值增大 |
17.用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ②⑤⑥ |
4.从樟科植物枝叶提取的精油中含有一种有机物 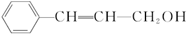 ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )
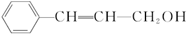 ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )| A. | 能使溴水、酸性高锰酸钾溶液褪色 | |
| B. | 分子中所有原子在同一平面内 | |
| C. | 分子式为C9H12O | |
| D. | 能发生加成反应、酯化反应、水解反应 |
14.有机物X是合成二氢荆芥内酯的重要原料,其结构简式为 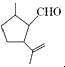 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,加热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加银氨溶液,加热,再加入溴水 | |
| D. | 先加入新制氢氧化铜悬浊液,加热,取清液酸化后再加溴水 |
18.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA | |
| C. | 标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA | |
| D. | 1L0.01mol•L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA |
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.