题目内容
15.硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]是一种稳定的还原剂,其制备流程如图1: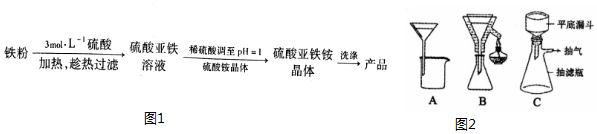
(1)硫酸浓度过大,反应过快同时会使FeSO4溶液中混有Fe3+(填离子符号).
(2)铁粉中混有少量P、S等元素,反应过程中产生的气体有刺激性气味,实验中应采取的措施在通风橱里进行.
(3)铁粉未完全反应,就得趁热过滤,图2中合适的过滤装置是B.
几种物质的溶解度(g/100gH2O)
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 70℃ |
| FeSO4•7H2O | 28.8 | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4 | 70.6 | 73 | 75.4 | 78.0 | 81 | 84.5 | 94.9 |
| (NH4)2SO4•FeSO4•6H2O | 14.5 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(5)将(NH4)2SO4晶体加入到FeSO4滤液中,加热搅拌至全部溶解,再蒸发浓缩至溶液表面有晶膜出现时,静置冷却结晶,抽滤,用少量乙醇洗涤晶体2~3次,将晶体放在表面皿上晾干,最终得到的产品质量为19.6g,本次实验产率为77.8%(本次实验使用4.0g铁粉,剩余0.4g未反应).
分析 (1)浓硫酸具有强氧化性;
(2)有刺激性气味有毒的气体要在通风橱里进行;
(3)考虑B装置能保持温度;
(4)根据表中物质的溶解度可知(NH4)2Fe(SO4) 2•6H2O溶解度较小析出;
(5)将(NH4)2SO4晶体加入到FeSO4滤液中,加热搅拌至全部溶解,再蒸发浓缩至溶液表面有晶膜出现时,静置冷却结晶,抽滤,用少量乙醇洗涤晶体2~3次,将晶体放在表面皿上晾干可得产品;根据铁元素守恒,由参与反应的铁粉计算产品的理论产量,再计算产率.
解答 解:(1)浓硫酸具有强氧化性,能将铁氧化到高价态的Fe3+;
故答案为:Fe3+;
(2)铁粉中混有少量P、S等元素,反应过程中产生的气体有刺激性气味,应在通风橱里进行;
故答案为:在通风橱里进行;
(3)铁粉未完全反应,就得趁热过滤,B装置能保证实验的温度,可使铁粉反应较为充分一些;
故答案为:B;
(4)从图中几种物质的溶解度可知:由于(NH4)2Fe(SO4) 2•6H2O溶解度较小,发生FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2•6H2O,析出晶体;
故答案为:由于(NH4)2Fe(SO4) 2•6H2O溶解度较小,发生FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2•6H2O,析出晶体;
(5)将(NH4)2SO4晶体加入到FeSO4滤液中,加热搅拌至全部溶解,再蒸发浓缩至溶液表面有晶膜出现时,静置冷却结晶,抽滤,用少量乙醇洗涤晶体2~3次,将晶体放在表面皿上晾干可得产品;
由铁元素守恒,本次实验使用4.0g铁粉,剩余0.4g未反应,则有:
Fe~(NH4)2Fe(SO4) 2•6H2O
56 392
4.0g-0.4g m
产品的理论产量为m=$\frac{392×3.6g}{56}$=25.2g,则本次实验产率为$\frac{19.6g}{25.2g}×100%$≈77.8%;
故答案为:蒸发浓缩;乙醇;77.8%.
点评 本题考查了物质的制备,涉及物质的 性质,实验操作,计算等知识点,为高考常见题型,注意对基础知识和常见物质性质的掌握,对题目信息的提取,题目难度中等.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案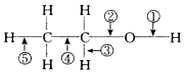
| A. | 与浓硫酸混合加热至170℃,断②⑤ | B. | 与氢卤酸反应断② | ||
| C. | 分子间脱水断①或② | D. | 与醋酸反应断② |
| A. | 在标准状况下,22.4L 水所含分子数目为 NA | |
| B. | 1mol•L-1K2SO4溶液所含 K+数目为 2NA | |
| C. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| D. | O2 的摩尔体积约为 22.4 L•mol-1 |
| A. | 物质 | B. | 分子 | C. | 原子 | D. | 离子 |
| A. | 化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的 | |
| B. | 某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离平衡常数可以表示弱电解质的相对强弱 |
| A. | H2SO4→2H++SO42 | B. | Ba(OH)2→Ba2++(OH)2 | ||
| C. | FeCl3→Fe2++3Cl- | D. | NaHCO3→Na++H++CO32- |
 如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | e处变红色 | 还原性:Fe2+>Cl- |
| D | d处立即褪色 | 氯气与水生成了漂白性物质 |
| A. | A | B. | B | C. | C | D. | D |
 .
.