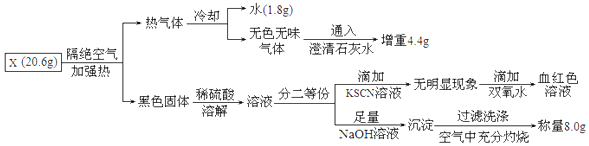
题目内容
7.下列说法正确的是( )| A. | 化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的 | |
| B. | 某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离平衡常数可以表示弱电解质的相对强弱 |
分析 A.K只与温度有关;
B.NaCl溶液中温度升高,Kw增大;
C.H2CO3为二元弱酸,分步电离;
D.Ka越大,电离程度越大,酸性越强.
解答 解:A.K只与温度有关,与溶液的浓度、气体的压强均无关,故A错误;
B.NaCl溶液中温度升高,Kw增大,而溶液为中性,故B错误;
C.H2CO3为二元弱酸,分步电离,Ka1=$\frac{c({H}^{+})•c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$,故C错误;
D.Ka越大,电离程度越大,酸性越强,则电离平衡常数可以表示弱电解质的相对强弱,故D正确;
故选D.
点评 本题考查平衡常数的意义,为高频考点,把握化学平衡常数、电离平衡常数、Kw的应用为解答的关键,侧重分析与应用能力的考查,注意K只与温度有关,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
16.下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( )
| A. | NH3 | B. | CH4 | C. | NaHCO3 | D. | HClO |
15.硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]是一种稳定的还原剂,其制备流程如图1:
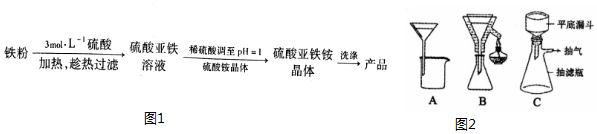
(1)硫酸浓度过大,反应过快同时会使FeSO4溶液中混有Fe3+(填离子符号).
(2)铁粉中混有少量P、S等元素,反应过程中产生的气体有刺激性气味,实验中应采取的措施在通风橱里进行.
(3)铁粉未完全反应,就得趁热过滤,图2中合适的过滤装置是B.
几种物质的溶解度(g/100gH2O)
(4)利用FeSO4与(NH4)2SO4制备(NH4)2Fe(SO4)2•6H2O的原理是由于(NH4)2Fe(SO4)2•6H2O溶解度较小,发生FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2•6H2O,析出晶体(用化学方程式及必要的文字说明).
(5)将(NH4)2SO4晶体加入到FeSO4滤液中,加热搅拌至全部溶解,再蒸发浓缩至溶液表面有晶膜出现时,静置冷却结晶,抽滤,用少量乙醇洗涤晶体2~3次,将晶体放在表面皿上晾干,最终得到的产品质量为19.6g,本次实验产率为77.8%(本次实验使用4.0g铁粉,剩余0.4g未反应).

(1)硫酸浓度过大,反应过快同时会使FeSO4溶液中混有Fe3+(填离子符号).
(2)铁粉中混有少量P、S等元素,反应过程中产生的气体有刺激性气味,实验中应采取的措施在通风橱里进行.
(3)铁粉未完全反应,就得趁热过滤,图2中合适的过滤装置是B.
几种物质的溶解度(g/100gH2O)
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 70℃ |
| FeSO4•7H2O | 28.8 | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4 | 70.6 | 73 | 75.4 | 78.0 | 81 | 84.5 | 94.9 |
| (NH4)2SO4•FeSO4•6H2O | 14.5 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(5)将(NH4)2SO4晶体加入到FeSO4滤液中,加热搅拌至全部溶解,再蒸发浓缩至溶液表面有晶膜出现时,静置冷却结晶,抽滤,用少量乙醇洗涤晶体2~3次,将晶体放在表面皿上晾干,最终得到的产品质量为19.6g,本次实验产率为77.8%(本次实验使用4.0g铁粉,剩余0.4g未反应).
2.下列说法中正确的是( )
| A. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| B. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中 |
19.同温同压下,含有相同氧原子数的SO2与CO气体,下列叙述正确的是( )
| A. | 物质的量之比为2:1 | B. | 体积之比为1:2 | ||
| C. | 质量之比为16:7 | D. | 密度之比为7:16 |
16.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用酸性高锰酸钾溶液可区分乙烷和乙烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 |