题目内容
4.在乙醇的化学性质中,各反应的断键方式不正确的是( )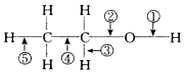
| A. | 与浓硫酸混合加热至170℃,断②⑤ | B. | 与氢卤酸反应断② | ||
| C. | 分子间脱水断①或② | D. | 与醋酸反应断② |
分析 A.乙醇和浓H2SO4共热至170℃时发生消去反应,断裂碳氧键、与羟基所连的碳的相邻的碳上的碳氢键;
B.乙醇和浓氢溴酸混合加热,发生取代反应;
C.乙醇和浓H2SO4共热至140℃时,发生分子间脱水,断开的是羟基上的氢氧键、碳氧键;
D.酯化反应中,酸去羟基,醇去氢.
解答 解:A.乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯,反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,故乙醇断键的位置为:②和⑤,故A正确;
B.乙醇与浓氢溴酸反应,生成溴乙烷和水,乙醇断裂②键,故B正确;
C.乙醇和浓H2SO4共热至140℃时,发生分子间脱水2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O,故乙醇断键的位置为①和②,故C正确;
D.与醋酸、浓硫酸共热时,发生酯化反应,醇脱H,O-H键断裂,即键①断裂,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇性质的考查,注意发生的反应及化学键的断裂位置,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
14.下列说法正确的是( )
| A. | 25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)<c(Na+) | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 足量锌分别和等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,放出H2的速率不等 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
12.某同学用氯气消毒的自来水配制下列溶液,不会引起药品明显变质的是( )
| A. | KOH | B. | AgNO3 | C. | MgCl2 | D. | Ca(OH)2 |
19.下列说法不正确的是( )
| A. | 聚乙烯、天然橡胶都是由高分子化合物组成的物质 | |
| B. | 用高锰酸钾溶液不可以鉴别直馏汽油和裂化汽油 | |
| C. | 有机物均含有C元素,但不是所有有机物均能发生燃烧反应 | |
| D. | 煤的气化、液化、干馏都属于化学变化 |
9.质量为ag的铜片在空气中灼烧变黑,趁热放入下列物质中后,质量大于ag的是( )
| A. | 澄清石灰水 | B. | 无水乙醇 | C. | 盐酸 | D. | 一氧化碳 |
16.下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( )
| A. | NH3 | B. | CH4 | C. | NaHCO3 | D. | HClO |
15.硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]是一种稳定的还原剂,其制备流程如图1:
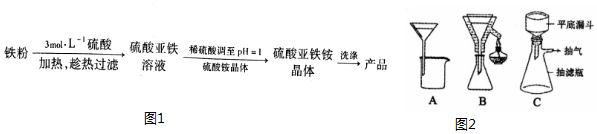
(1)硫酸浓度过大,反应过快同时会使FeSO4溶液中混有Fe3+(填离子符号).
(2)铁粉中混有少量P、S等元素,反应过程中产生的气体有刺激性气味,实验中应采取的措施在通风橱里进行.
(3)铁粉未完全反应,就得趁热过滤,图2中合适的过滤装置是B.
几种物质的溶解度(g/100gH2O)
(4)利用FeSO4与(NH4)2SO4制备(NH4)2Fe(SO4)2•6H2O的原理是由于(NH4)2Fe(SO4)2•6H2O溶解度较小,发生FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2•6H2O,析出晶体(用化学方程式及必要的文字说明).
(5)将(NH4)2SO4晶体加入到FeSO4滤液中,加热搅拌至全部溶解,再蒸发浓缩至溶液表面有晶膜出现时,静置冷却结晶,抽滤,用少量乙醇洗涤晶体2~3次,将晶体放在表面皿上晾干,最终得到的产品质量为19.6g,本次实验产率为77.8%(本次实验使用4.0g铁粉,剩余0.4g未反应).

(1)硫酸浓度过大,反应过快同时会使FeSO4溶液中混有Fe3+(填离子符号).
(2)铁粉中混有少量P、S等元素,反应过程中产生的气体有刺激性气味,实验中应采取的措施在通风橱里进行.
(3)铁粉未完全反应,就得趁热过滤,图2中合适的过滤装置是B.
几种物质的溶解度(g/100gH2O)
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 70℃ |
| FeSO4•7H2O | 28.8 | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4 | 70.6 | 73 | 75.4 | 78.0 | 81 | 84.5 | 94.9 |
| (NH4)2SO4•FeSO4•6H2O | 14.5 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(5)将(NH4)2SO4晶体加入到FeSO4滤液中,加热搅拌至全部溶解,再蒸发浓缩至溶液表面有晶膜出现时,静置冷却结晶,抽滤,用少量乙醇洗涤晶体2~3次,将晶体放在表面皿上晾干,最终得到的产品质量为19.6g,本次实验产率为77.8%(本次实验使用4.0g铁粉,剩余0.4g未反应).

 按要求回答下列问题:
按要求回答下列问题: