题目内容
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
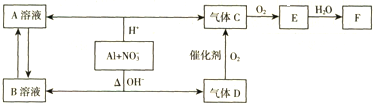
请回答下列问题:
(1)气体D和F反应可生成盐,该盐的化学式为 .
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质中σ键和Π键之比为 .
(3)将A转化为B,可选择的试剂是 (填字母)
a.CO2 b.NaOH c.CH3COOH d.NH3 e.HCl
(4)过量D的水溶液与A溶液反应的离子方程式是 .
(5)除去气体C中的杂质气体E的化学方法:将混合气体通入 中.
(6)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 .
(7)Al与NO3-在碱性条件下反应的离子方程式为 .

请回答下列问题:
(1)气体D和F反应可生成盐,该盐的化学式为
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质中σ键和Π键之比为
(3)将A转化为B,可选择的试剂是
a.CO2 b.NaOH c.CH3COOH d.NH3 e.HCl
(4)过量D的水溶液与A溶液反应的离子方程式是
(5)除去气体C中的杂质气体E的化学方法:将混合气体通入
(6)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是
(7)Al与NO3-在碱性条件下反应的离子方程式为
考点:铝的化学性质,无机物的推断
专题:推断题,元素及其化合物
分析:金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,由转化关系图可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸.
(1)氨气与硝酸反应生成的盐为硝酸铵;
(2)氨气可以和一氧化氮或是二氧化氮发生氧化还原反应生成无毒气体单质为氮气.共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键;
(3)Al(OH)3溶于强酸、强碱,故由硝酸铝盐得到偏铝酸盐最佳试剂是NaOH;
(4)D为氨气,A为硝酸铝,铝离子和氨水反应生成氢氧化铝;
(5)C为NO,E为二氧化氮,能和水反应生成HNO3和NO气体,可将二氧化氮转化为NO;
(6)Al与NO3-在酸性条件下反应生成铝盐、NO;
(7)金属铝在碱性环境下可以和硝酸根反应生成偏铝酸盐和氨气.
(1)氨气与硝酸反应生成的盐为硝酸铵;
(2)氨气可以和一氧化氮或是二氧化氮发生氧化还原反应生成无毒气体单质为氮气.共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键;
(3)Al(OH)3溶于强酸、强碱,故由硝酸铝盐得到偏铝酸盐最佳试剂是NaOH;
(4)D为氨气,A为硝酸铝,铝离子和氨水反应生成氢氧化铝;
(5)C为NO,E为二氧化氮,能和水反应生成HNO3和NO气体,可将二氧化氮转化为NO;
(6)Al与NO3-在酸性条件下反应生成铝盐、NO;
(7)金属铝在碱性环境下可以和硝酸根反应生成偏铝酸盐和氨气.
解答:
解:金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,由转化关系图可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸,
(1)氨气(NH3)易与酸反应,氨气与硝酸反应NH3+HNO3=NH4NO3,故答案为:NH4NO3;
(2)氨气可以和一氧化氮或是二氧化氮发生氧化还原反应生成无毒气体单质为氮气,化学式为N2,共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键,所以该单质中σ键和Π键之比为1:2,
故答案为:1:2;
(3)Al(OH)3溶于强酸、强碱,A1Cl3+3NaOH═A1(OH)3↓+3NaCl,A1(OH)3+NaOH═NaAlO2+2H2O,故由硝酸铝盐得到偏铝酸盐最佳试剂是NaOH,
故答案为:b;
(4)氨水是弱碱,不能溶解氢氧化铝,D为氨气,A为硝酸铝,铝离子和氨水反应:3NH3+3H2O+Al3+═Al(OH)3↓+3NH4+ (或3NH3?H2O+Al3+═Al(OH)3↓+3NH4+),
故答案为:3NH3+3H2O+Al3+═Al(OH)3↓+3NH4+ (或3NH3?H2O+Al3+═Al(OH)3↓+3NH4+);
(5)二氧化氮和水生成HNO3和NO气体,3N02+H2O=2HNO3+NO,通过水洗可除去气体C中的杂质气体E,故答案为:水;
(6)Al与NO3-在酸性条件下反应生成铝盐、NO,反应离子方程式为:Al+NO3-+4H+=Al3++NO↑+2H2O,被还原的NO3-生成NO,Al与被还原的NO3-的物质的量之比是1:1,
故答案为:1:1;
(7)金属铝在碱性环境下可以和硝酸根反应生成偏铝酸盐和氨气,离子方程式为:8Al+3NO3-+5OH-+18H2O═8[Al(OH)4]-+3NH3↑或8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑,
故答案为:8Al+3NO3-+5OH-+18H2O═8[Al(OH)4]-+3NH3↑或8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑.
(1)氨气(NH3)易与酸反应,氨气与硝酸反应NH3+HNO3=NH4NO3,故答案为:NH4NO3;
(2)氨气可以和一氧化氮或是二氧化氮发生氧化还原反应生成无毒气体单质为氮气,化学式为N2,共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键,所以该单质中σ键和Π键之比为1:2,
故答案为:1:2;
(3)Al(OH)3溶于强酸、强碱,A1Cl3+3NaOH═A1(OH)3↓+3NaCl,A1(OH)3+NaOH═NaAlO2+2H2O,故由硝酸铝盐得到偏铝酸盐最佳试剂是NaOH,
故答案为:b;
(4)氨水是弱碱,不能溶解氢氧化铝,D为氨气,A为硝酸铝,铝离子和氨水反应:3NH3+3H2O+Al3+═Al(OH)3↓+3NH4+ (或3NH3?H2O+Al3+═Al(OH)3↓+3NH4+),
故答案为:3NH3+3H2O+Al3+═Al(OH)3↓+3NH4+ (或3NH3?H2O+Al3+═Al(OH)3↓+3NH4+);
(5)二氧化氮和水生成HNO3和NO气体,3N02+H2O=2HNO3+NO,通过水洗可除去气体C中的杂质气体E,故答案为:水;
(6)Al与NO3-在酸性条件下反应生成铝盐、NO,反应离子方程式为:Al+NO3-+4H+=Al3++NO↑+2H2O,被还原的NO3-生成NO,Al与被还原的NO3-的物质的量之比是1:1,
故答案为:1:1;
(7)金属铝在碱性环境下可以和硝酸根反应生成偏铝酸盐和氨气,离子方程式为:8Al+3NO3-+5OH-+18H2O═8[Al(OH)4]-+3NH3↑或8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑,
故答案为:8Al+3NO3-+5OH-+18H2O═8[Al(OH)4]-+3NH3↑或8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑.
点评:本题考查无机物的推断,侧重铝、氮及其化合物转化的考查,明确发生的反应推断各物质为解答的关键,题目难度中等.注意Al(OH)3溶于强酸、强碱,氨水不能溶解氢氧化铝,为高频考点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图为反应3Cu+8HNO3(稀)=3Cu(NO3)3+2NO↑+4H2O中电子转移的关系图,则图中的元素甲、乙分别表示( )
如图为反应3Cu+8HNO3(稀)=3Cu(NO3)3+2NO↑+4H2O中电子转移的关系图,则图中的元素甲、乙分别表示( )| A、Cu,O | B、Cu,H |
| C、H,O | D、Cu,N |
关于化学平衡常数的叙述正确的是( )
| A、化学平衡常数与温度无关 |
| B、两种物质反应,不管怎样书写化学方程式,平衡常数不变 |
| C、化学平衡常数等于某时刻生成物浓度幂之积与反应物浓度幂之积的比值 |
| D、温度一定,对于给定的化学反应,正逆反应的平衡常数互为倒数 |
质量相同的两份铝粉,第一份中加入足量的NaOH溶液,第二份中加入足量的盐酸,在同温同压下放出气体的体积比是( )
| A、1:2 | B、2:1 |
| C、1:4 | D、1:1 |
标准状况下有①0.112L水 ②3.01×1023个氯化氢分子 ③13.6g H2S气体 ④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
| A、体积:①④③② |
| B、密度:④①②③ |
| C、质量:①④③② |
| D、氢原子数:①③④② |
下列各组内离子之间不能发生离子反应的是( )
| A、HCO3-、NH4+、H+、Ca2+ |
| B、SO42-、H+、Cl-、NO3- |
| C、K+、Ag+、Na+、CO32- |
| D、Mg2+、OH-、SO32-、Cl-- |

 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: