题目内容
下列各组内离子之间不能发生离子反应的是( )
| A、HCO3-、NH4+、H+、Ca2+ |
| B、SO42-、H+、Cl-、NO3- |
| C、K+、Ag+、Na+、CO32- |
| D、Mg2+、OH-、SO32-、Cl-- |
考点:离子共存问题
专题:离子反应专题
分析:A.氢离子能够与碳酸氢根离子发生反应生成二氧化碳气体和水;
B.SO42-、H+、Cl-、NO3-离子之间不满足离子反应发生条件;
C.银离子、碳酸根离子之间发生反应生成碳酸银沉淀;
D.镁离子与氢氧根离子反应生成难溶物氢氧化镁.
B.SO42-、H+、Cl-、NO3-离子之间不满足离子反应发生条件;
C.银离子、碳酸根离子之间发生反应生成碳酸银沉淀;
D.镁离子与氢氧根离子反应生成难溶物氢氧化镁.
解答:
解:A.HCO3-、H+之间反应生成二氧化碳气体和水,在溶液中不能大量共存,故A错误;
B.SO42-、H+、Cl-、NO3-之间不发生反应,在溶液中能够大量共存,故B正确;
C.Ag+、CO32-之间反应生成碳酸银沉淀,在溶液中不能大量共存,故C错误;
D.Mg2+、OH-之间发生反应生成氢氧化镁沉淀,在溶液中不能大量共存,故D错误;
故选B.
B.SO42-、H+、Cl-、NO3-之间不发生反应,在溶液中能够大量共存,故B正确;
C.Ag+、CO32-之间反应生成碳酸银沉淀,在溶液中不能大量共存,故C错误;
D.Mg2+、OH-之间发生反应生成氢氧化镁沉淀,在溶液中不能大量共存,故D错误;
故选B.
点评:本题考查了离子反应发生条件,为中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等.

练习册系列答案
相关题目
 16、下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )
16、下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6的分子空间构型为正八面体 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |
相同物质的量浓度的下列化合物的水溶液,按pH由大到小的顺序排列是( )
| A、NaHSO4 CH3COONa NH4Cl NaNO3 |
| B、NaNO3 CH3COONa NaHSO4 NH4Cl |
| C、CH3COONa NaNO3 NH4Cl NaHSO4 |
| D、NaNO3CH3COONa NH4Cl NaHSO4 |
有两个带活塞的密闭容器A和B,A中装有N2,B中装有NO2,它们的温度、压强、体积均相同,然后慢慢压缩活塞,当两个容器内的压强都是原来5倍时(恒温),则两个容器的体积关系是( )
| A、相等 | B、A>B |
| C、B>A | D、无法判断 |
已知:N2(g)+3H2(g)?2NH3(l)△H=-132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,下列说法正确的是( )
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
A、如图可表示合成氨过程中的能量变化 |
| B、a的数值为1173 |
| C、Q的数值为92 |
| D、其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量 |
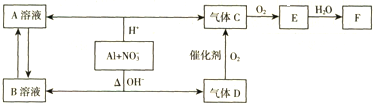
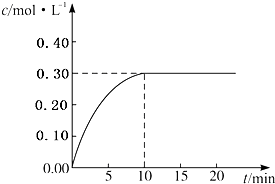 目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:
目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示: