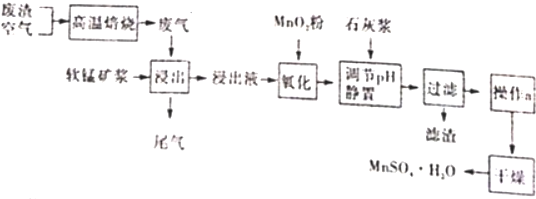
题目内容
2.下列说法正确的是( )| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>VNaOH | |
| C. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| D. | NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
分析 A、三氧化硫的水溶液是硫酸溶液,导电的不是三氧化硫本身;
B、用醋酸溶液滴定等浓度NaOH溶液,恰好完全反应,得到的醋酸钠溶液显示碱性;
C、在蒸馏水中滴加浓H2SO4,浓硫酸的稀释释放热量,水的离子积受温度的影响;
D、氯化钠对水的电离平衡无影响,但是醋酸铵中醋酸根离子和铵根离子均促进水的电离.
解答 解:A、三氧化硫的水溶液是硫酸溶液,导电的不是三氧化硫本身,属于非电解质,故A错误;
B、用醋酸溶液滴定等浓度NaOH溶液,恰好完全反应,得到的醋酸钠溶液显示碱性,若要达到pH=7,需要醋酸稍过量,所以V醋酸>VNaOH,故B正确;
C、在蒸馏水中滴加浓H2SO4,浓硫酸的稀释释放热量,水的离子积受温度的影响,温度升高,水的离子积增大,故C错误;
D、氯化钠对水的电离平衡无影响,但是醋酸铵中醋酸根离子和铵根离子均促进水的电离,所以两溶液中水的电离程度不相同,故D错误.
故选B.
点评 本题涉及电解质的判断、水的离子积的影响因素、盐的水解原理等知识,属于综合知识的考查,难度中等.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
12.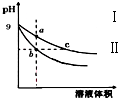 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | c点溶液中c (H+)=c (OH-)+c (CH3COOH) | |
| D. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb=Vc |
13.(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇. 某化学研究性学习小组模拟工业合成甲醇的反应(△H<0),在容积固定为2L的密闭容器内充入1molCO和 2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
(1)从反应开始到20min时,以CO表示的平均反应速率=0.0125mol/(L•min),
(2)该温度下平衡常数K=4(mol/L)-2,,若升高温度则K值减小(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是BC;
A.2v (H2)正=v (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ•mol-1
(1)该反应500℃时的平衡常数<450℃时的平衡常数(填“>”、“<”或“=”).
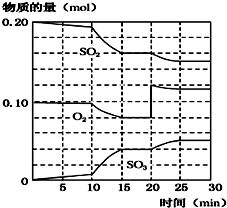
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧化混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是15~20 min和25~30 min.
(3)据图判断,反应进行至20min时,曲线发生变化的原因是增大O2浓度(通入O2);(用文字表达),10min到15min的曲线变化的原因可能是AB(填字母).
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是b.(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度.
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(2)该温度下平衡常数K=4(mol/L)-2,,若升高温度则K值减小(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是BC;
A.2v (H2)正=v (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:

2SO2(g)+O2(g)?2SO3(g)△H=-190kJ•mol-1
(1)该反应500℃时的平衡常数<450℃时的平衡常数(填“>”、“<”或“=”).
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧化混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是15~20 min和25~30 min.
(3)据图判断,反应进行至20min时,曲线发生变化的原因是增大O2浓度(通入O2);(用文字表达),10min到15min的曲线变化的原因可能是AB(填字母).
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是b.(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度.
7.Cl2是纺织工业中常用的漂白剂.Na2S2O3可作漂白布匹后的“脱氯剂”,脱氯反应为S2O32-+Cl2++H20→SO42-+Cl-+H+ (未配平),下列对该反应的说法不正确的是( )
| A. | 反应每脱去1mol Cl2会生成1molSO42- | |
| B. | 脱氯反应后的溶液显酸性 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | 反应中硫元素发生了氧化反应 |
11.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
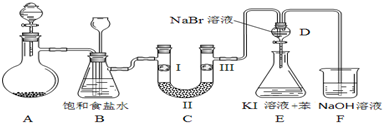
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |