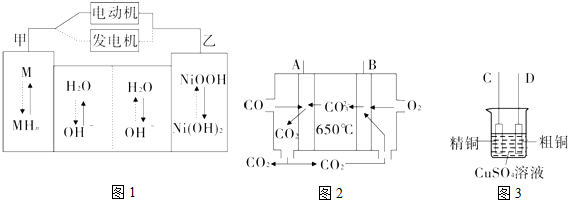
题目内容
1.对于反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,以下叙述正确的是( )| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为5:1 | |
| C. | 每生成1mol的NaClO3转移6mol的电子 | |
| D. | Cl2既是氧化剂又是还原剂 |
分析 3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:A.因氯气中Cl元素的化合价既升高又降低,则Cl2既是氧化剂也是还原剂,氢氧化钠中各元素的化合价都不变,所以氢氧化钠既不是氧化剂又不是还原剂,故A错误;
B.被氧化的氯原子和被还原的氯原子的物质的量之比为1:5,故B错误;
C.生成1mol的NaClO3转移5mol的电子,故C错误;
D.因氯气中Cl元素的化合价既升高又降低,则Cl2既是氧化剂也是还原剂,故D正确;
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意D中电子守恒的分析,题目难度不大.

练习册系列答案
相关题目
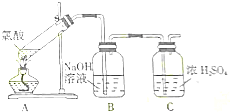
11.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
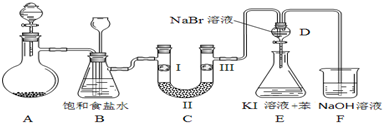
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
12.有A、B、C、D四种一元酸的溶液.实验表明:
(1)物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C中不变色;
(2)物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH;
(3)A酸和D的钠盐反应生成A的钠盐和D酸.
由此可以确定四种酸的酸性由强到弱的顺序中正确的是( )
(1)物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C中不变色;
(2)物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH;
(3)A酸和D的钠盐反应生成A的钠盐和D酸.
由此可以确定四种酸的酸性由强到弱的顺序中正确的是( )
| A. | B>C>A>D | B. | A>C>D>B | C. | D>A>C>B | D. | C>D>A>B |
13.已知FeCl3溶液与KSCN溶液混合后发生反应FeCl3+3KSCN?Fe(SCN)3+3KCl,达到平衡后,改变条件,则下列说法正确的是( )
| A. | 向溶液中加入少许KCl固体,溶液颜色变浅 | |
| B. | 升高温度,平衡一定发生移动 | |
| C. | 加入少许KCl固体或者加入少许FeCl3固体平衡常数均发生变化,且变化方向相反 | |
| D. | 平衡常数表达式为K=$\frac{c[Fe(SCN)_{3}]•{c}^{3}(KCl)}{c(FeC{l}_{3})•{c}^{3}(KSCN)}$ |