题目内容
11.某温度下,液氨的离子积常数K=c(NH4+)•c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是( )| A. | 纯净的液氨中,pN=7 | |
| B. | 纯净的液氨中,c(NH4+)•c(NH2-)>1.0×10-14 | |
| C. | 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3 | |
| D. | 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11 |
分析 A、纯净的液氨中,pN=-lg c(NH4+)=$\sqrt{K}$,据此回答;
B、纯净的液氨中,K=c(NH4+)•c(NH2-)其K的值只受温度的影响;
C、1 L溶解有0.001 mol NH4C1的液氨溶液,其c(NH4+)=0.001mol/L;
D、L溶解有0.001 mol NaNH2的液氨溶液,c(NH4+)≠0.001mol/L.
解答 解:A、纯净的液氨中,pN=-lg c(NH4+)=-lg$\sqrt{K}$≠7,故A错误;
B、纯净的液氨中,K=c(NH4+)•c(NH2-),K的值只受温度的影响,温度不知道,无法比较大小,B错误;
C、1 L溶解有0.001 mol NH4C1的液氨溶液,其c(NH4+)=0.001mol/L,pN=-lg c(NH4+)=3,故C正确;
D、1 L溶解有0.001 mol NaNH2的液氨溶液,c(NH4+)≠0.001mol/L,pN=-lg c(NH4+)≠3,故D错误.
故选C.
点评 本题属于知识的迁移应用,可以按照水的电离平衡处理,只是平衡常数不同,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出a kJ的热量,试写出表示甲烷燃烧热的热化学方程式:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol;
(2)已知反应CH3-CH3(g)→CH2═CH2(g)+H2(g),有关化学键的键能如下:
通过计算得出该反应的反应热为+125.6kJ/mol;
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算25OC时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H= +227.7kJ•mol-1.
(1)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出a kJ的热量,试写出表示甲烷燃烧热的热化学方程式:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol;
(2)已知反应CH3-CH3(g)→CH2═CH2(g)+H2(g),有关化学键的键能如下:
| 化学键 | C-H | C═C | C-C | H-H |
| 键能/kJ•mol-1 | 414.4 | 615.3 | 347.3 | 435.3 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算25OC时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H= +227.7kJ•mol-1.
2.研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)?CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)?2H2O (g)△H3=-483.6kJ•mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为CH4(g)+$\frac{1}{2}$O2(g)?CH3OH(l)△H1=-164.0kJ•mol-1.
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
①实验2和实验3相比,其平衡常数关系是K2>K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为90.9%.
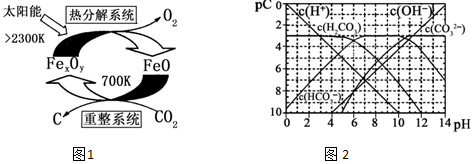
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
2“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为Fe3O4.
②“热分解系统”中每分解l mol Fe xOy,转移电子的物质的量为2mol.
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10-3mol•L-1,则该溶液中溶质的pC=-lg(1×10-3)=3.如图2为25℃时H2CO3溶液的pC-pH图.请回答下列问题 (若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-不能(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1=1×10-6.
③人体血液里主要通过碳酸氢盐缓冲体系$\frac{c({H}_{2}C{O}_{3})}{c(HC{O}_{3}^{-})}$可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的$\frac{c({H}^{+})}{c({H}_{2}C{O}_{3})}$最终将A.
A.变大B.变小C.基本不变D.无法判断.
(1)已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)?CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)?2H2O (g)△H3=-483.6kJ•mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为CH4(g)+$\frac{1}{2}$O2(g)?CH3OH(l)△H1=-164.0kJ•mol-1.
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为90.9%.
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
2“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为Fe3O4.
②“热分解系统”中每分解l mol Fe xOy,转移电子的物质的量为2mol.

(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10-3mol•L-1,则该溶液中溶质的pC=-lg(1×10-3)=3.如图2为25℃时H2CO3溶液的pC-pH图.请回答下列问题 (若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-不能(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1=1×10-6.
③人体血液里主要通过碳酸氢盐缓冲体系$\frac{c({H}_{2}C{O}_{3})}{c(HC{O}_{3}^{-})}$可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的$\frac{c({H}^{+})}{c({H}_{2}C{O}_{3})}$最终将A.
A.变大B.变小C.基本不变D.无法判断.
19.下列反应中,电子转移发生在同种元素之间的是( )
| A. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | H2S+Cl2=S+2HCl | D. | Cu2O+H2SO4=CuSO4+Cu+H2O |
6.学习化学过程中需要经常做实验,下列实验操作正确的是( )
| A. |  闻气味 | B. |  倾倒液体 | C. |  取粉末 | D. |  过滤 |
16.下列反应中不属于氧化还原反应的是( )
| A. | 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | 3Cl2+6KOH=5KCl+KClO3+3H2O | |
| C. | 3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl | |
| D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
3.下列关于氯气的实验装置能达到实验目的或实验效果的是( )
| A. | 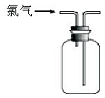 可用于氯气的收集 | B. | 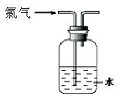 用于除去氯气中少量的氯化氢气体 | ||
| C. |  可证明氯气具有漂白性 | D. | 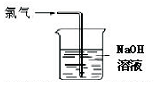 可用于实验室氯气的尾气吸收 |
20.氯碱工业是以电解饱和食盐水为基础的工业.饱和食盐水是以含Ca2+、Mg2+、SO42-、Fe3+等杂质离子的粗盐水精制,需要使用的药品包括:①稀盐酸 ②烧碱溶液 ③碳酸钠溶液 ④氯化钡溶液.下列有关说法不正确的是( )
| A. | 加入烧碱溶液主要是除去Mg2+、Fe3+ | |
| B. | 药品加入的先后顺序可以是②③④① | |
| C. | 加入稀盐酸主要是除去所加过量物质中的OH-、CO32- | |
| D. | 加入碳酸钠溶液主要是除去Ca2+及所加过量物质中的Ba2+ |
1.向含有c(FeCl3)=0.2mol•L-1、c(FeCl2)=0.1mol•L-1的混合溶液中滴加稀NaOH溶液可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na分离开 | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 当光束通过该分散系时,可以看到一条光亮的“通路” |