题目内容
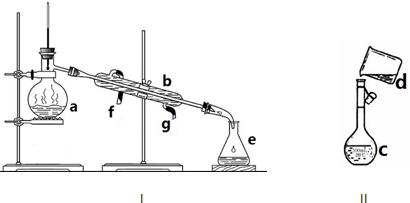
三氯化磷(PCl3)是一种重要的半导体材料掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示.

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3,POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见下表.
请答下面问题:
(1)A装置中制氯气的离子方程式为 .
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 .
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是 ,C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是 .
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3.

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3,POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见下表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为
(2)B中所装试剂是
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应;
(1)A装置中二氧化锰和浓盐酸反应制取氯气,反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,据此书写离子反应方程式;
(2)氯气为酸性气体,需用酸性干燥剂干燥,三氯化磷沸点低,可用冷水冷凝收集,碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度;
(3)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,黄磷(白磷)能自燃,通入二氧化碳赶净空气,避免水和氧气与三氯化磷发生反应;先关闭K1,打开K2,利用氯气排净装置中的空气;
(4)依据物质的沸点数值不同,可以利用蒸馏的方法分离出三氯化磷.
(1)A装置中二氧化锰和浓盐酸反应制取氯气,反应为MnO2+4HCl(浓)
| ||
(2)氯气为酸性气体,需用酸性干燥剂干燥,三氯化磷沸点低,可用冷水冷凝收集,碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度;
(3)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,黄磷(白磷)能自燃,通入二氧化碳赶净空气,避免水和氧气与三氯化磷发生反应;先关闭K1,打开K2,利用氯气排净装置中的空气;
(4)依据物质的沸点数值不同,可以利用蒸馏的方法分离出三氯化磷.
解答:
解:实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应.
(1)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
故答案为:浓硫酸;防止PCl3挥发(冷凝);吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应;
(3)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应,先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,排净了空气,再打开K1,关闭K2,
故答案为:排尽装置中的空气,防止黄磷(白磷)自燃;先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2;
(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答案为:蒸馏.
(1)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
故答案为:浓硫酸;防止PCl3挥发(冷凝);吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应;
(3)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应,先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,排净了空气,再打开K1,关闭K2,
故答案为:排尽装置中的空气,防止黄磷(白磷)自燃;先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2;
(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答案为:蒸馏.
点评:本题考查阅读获取信息的能力、对实验原理理解等,题目难度较大,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,注意题中信息PCl3遇O2会生成POCl3,POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点为解答关键.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
下列关于乙酸的说法不正确的是( )
| A、乙酸分子中含有碳氧双键,所以乙酸能使酸性高锰酸钾溶液褪色 |
| B、乙酸俗称醋酸,无水乙酸又称为冰醋酸,它是纯净物 |
| C、乙酸是重要的有机酸,是一种有刺激性气味的液体 |
| D、可以用乙酸除去热水瓶中的水垢 |
核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振氢谱图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的核磁共振氢谱如下图所示,则它可能是( )


| A、CH3CH2CH3 |
| B、CH3CH2CH2OH |
| C、(CH3)2CHCH3 |
| D、CH3CH2CHO |
为比较盐酸与醋酸的酸性强弱,下列方案不可行的是(均在常温下测定)( )
| A、比较等体积、等pH值的两种溶液的导电性 |
| B、比较等物质的量浓度的氯化钠与醋酸钠溶液的pH值 |
| C、比较等体积、等pH值的两种溶液与过量锌粉反应产生氢气的量 |
| D、比较等体积、等物质的量浓度的两种溶液稀释相同倍数后的pH变化 |