题目内容
Cl2+2NaOH═NaCl+NaClO+H2O,0.1mol Cl2反应时,转移 mol电子.
考点:氧化还原反应
专题:
分析:该反应中Cl元素化合价由0价变为-1价和+1价,NaOH中各元素化合价不变,所以Cl2既是氧化剂又是还原剂,根据方程式知,参加反应的氯气有一半作氧化剂一半作还原剂,根据元素化合价变化及作还原剂的氯气进行计算.
解答:
解:该反应中Cl元素化合价由0价变为-1价和+1价,NaOH中各元素化合价不变,所以Cl2既是氧化剂又是还原剂,根据方程式知,参加反应的氯气有一半作氧化剂一半作还原剂,所以0.1mol Cl2反应时,转移电子的物质的量=
×0.1mol×2×(1-0)=0.1mol,故答案为:0.1.
| 1 |
| 2 |
点评:本题考查氧化还原反应计算,明确元素化合价变化是解本题关键,根据氧化剂或还原剂与转移电子之间的关系式计算即可,题目难度不大.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式错误的是( )
| A、向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
| B、酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+O2↑ |
| C、向碳酸氢钙溶液中滴入少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、向氨水中通入少量的二氧化硫气体:2NH3?H2O+SO2=2NH4++SO32-+H2O |
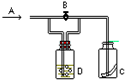 如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条无变化; 打开B阀时,C处干燥的红色布条褪色,则D中的溶液是( )
如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条无变化; 打开B阀时,C处干燥的红色布条褪色,则D中的溶液是( )| A、浓盐酸 |
| B、H2O |
| C、NaOH溶液 |
| D、饱和食盐水 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体是一种重要的半导体材料.下列说法正确的是( )
| A、X、M两种元素形成的化合物的中一定含有离子键,不可能含有共价键 |
| B、由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低 |
| C、元素Y、Z、W、M的电负性高低顺序为:M>W>Z>Y |
| D、化合物ZW2的分子空间构型为直线形 |