题目内容
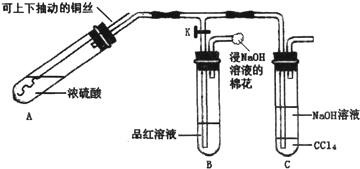
某研究小组利用如图装置探究铜与浓硫酸反应的产物.
实验步骤与现象如下:
①检查装置气密性,向A中加入5mL浓硫酸,打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K.
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热.
将回答下列问题:
(1)溶液中白色固体是 (填化学式),C中CCl4的作用是 .
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝.写出A中可能发生反应的化学方程式: 、 .
(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生.
①分离的操作名称为: :
②白色沉淀为: ;
⑨产生白色沉淀的原因可能是 .

实验步骤与现象如下:
①检查装置气密性,向A中加入5mL浓硫酸,打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K.
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热.
将回答下列问题:
(1)溶液中白色固体是
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝.写出A中可能发生反应的化学方程式:
(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生.
①分离的操作名称为:
②白色沉淀为:
⑨产生白色沉淀的原因可能是
考点:浓硫酸的性质实验
专题:氧族元素
分析:(1)铜和浓硫酸反应生成硫酸铜,加热的情况下,由于A容器中出现大量白色烟雾,导致溶剂减少,且浓硫酸具有吸水性,所以会析出白色固体硫酸铜;二氧化硫难溶于CCl4,可防止倒吸;
(2)先根据铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,然后根据取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝,说明铜与硫酸反应也生成氧化铜,最后根据氧化还原反应规律书写化学方程式;
(3)①两种互不相溶的液体采用分液的方法分离;
②BaCl2溶液与亚硫酸钠反应生成亚硫酸钡,亚硫酸钡能与盐酸反应生成氯化钡、水、二氧化碳,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生,说明沉淀为硫酸钡;
③亚硫酸钡能被氧气氧化生成硫酸钡.
(2)先根据铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,然后根据取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝,说明铜与硫酸反应也生成氧化铜,最后根据氧化还原反应规律书写化学方程式;
(3)①两种互不相溶的液体采用分液的方法分离;
②BaCl2溶液与亚硫酸钠反应生成亚硫酸钡,亚硫酸钡能与盐酸反应生成氯化钡、水、二氧化碳,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生,说明沉淀为硫酸钡;
③亚硫酸钡能被氧气氧化生成硫酸钡.
解答:
解:(1)铜和浓硫酸反应生成硫酸铜,加热的情况下,由于A容器中出现大量白色烟雾,导致溶剂减少,且浓硫酸具有吸水性,所以会析出白色固体硫酸铜;二氧化硫难溶于CCl4,可防止倒吸;
故答案为:无水CuSO4;防止倒吸;
(2)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,也可能生成氧化铜、二氧化硫和水,反应的化学方程式为:Cu+H2SO4(浓)
CuO+SO2↑+H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;Cu+H2SO4(浓)
CuO+SO2↑+H2O,
(3)①分离出C中的上层液体,采用分液的方法分离,故答案为:分液;
②BaCl2溶液与亚硫酸钠反应生成亚硫酸钡,亚硫酸钡能与盐酸反应生成氯化钡、水、二氧化碳,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生,说明沉淀为硫酸钡,故答案为:硫酸钡;
③亚硫酸钡能被氧气氧化生成硫酸钡,硫酸钡与稀盐酸不反应,故答案为:装置中的氧气参与了反应.
故答案为:无水CuSO4;防止倒吸;
(2)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)
| ||
| ||
故答案为:Cu+2H2SO4(浓)
| ||
| ||
(3)①分离出C中的上层液体,采用分液的方法分离,故答案为:分液;
②BaCl2溶液与亚硫酸钠反应生成亚硫酸钡,亚硫酸钡能与盐酸反应生成氯化钡、水、二氧化碳,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生,说明沉淀为硫酸钡,故答案为:硫酸钡;
③亚硫酸钡能被氧气氧化生成硫酸钡,硫酸钡与稀盐酸不反应,故答案为:装置中的氧气参与了反应.
点评:本题考查了浓硫酸与铜的反应,题目难度中等,注意掌握浓硫酸的化学性质,能够确定反应产物是解题的关键.

练习册系列答案
相关题目
下列有机物的命名中,不正确的是( )
| A、4-甲基-3-乙基-2-己烯 |
| B、3-甲基-3-乙基戊烷 |
| C、3,3-二甲基丁烷 |
| D、3-甲基苯乙烯 |
下列混合物能用分液法分离的是( )
| A、乙醇与乙酸 | B、苯和乙醇 |
| C、苯和水 | D、乙醇和水 |
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Zn-2e-+2OH-=Zn(OH)2Ag2O+H2O+2e-=2Ag+2OH-.下列说法正确的是( )
| A、溶液中OH-向正极移动,K+、H+向负极移动 |
| B、锌发生还原反应,氧化银发生氧化反应 |
| C、锌是负极,氧化银是正极 |
| D、在电池放电过程中,负极区溶液碱性增强 |