题目内容
5.下列离予方程式书写正确的是( )(1)MgSO4溶液与Ba(OH)2溶液混合:Mg2++2OH-═Mg(OH)2↓
(2)用惰性电极电解Na2S溶液:S2-+2H2O$\frac{\underline{\;电解\;}}{\;}$S↓+H2↑+2OH-
(3)FeBr2溶液中通入过量氯气:2Fe2++Cl2═2Fe3++2Cl-
(4)FeCl3溶液中撒入CaCO3粉末有气泡产生:2Fe3++3CaCO3+3H2O═2Fe(OH)3↓+3Ca2++3CO2↑
(5)氨水吸收少量的二氧化硫:NH3•H2O+SO2═NH4++HSO3-
(6)用两个铜片作电极电解盐酸有:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cu2+
(7)用石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-
(8)Na2O2加入到足量H218O中:2Na2O2+2H218O═4Na++4OH-+18O2↑
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 (1)漏掉了钡离子与硫酸根离子生成硫酸钡的反应;
(2)用惰性电极电解Na2S溶液,阳极生成S单质,阴极生成氢气;
(3)往FeBr2溶液中通入过量C12,氯气过量,则二价铁离子、溴离子都被氧化;
(4)FeCl3溶液中撒入CaCO3粉末有气泡产生,实现了沉淀的转化;
(5)氨水吸收少量的二氧化硫,二氧化硫少量,反应生成的是亚硫酸铵;
(6)电解池中,金属铜作阳极时,铜电极本身失去电子,阴极是盐酸中的氢离子放电;
(7)用石墨作电极电解氯化铝溶液生成氢氧化铝、氢气和氯气;
(8)过氧化钠加入到足量H218O中,过氧化钠既做氧化剂又做还原剂,生成的氧气为O2.
解答 解:(1)MgSO4溶液与Ba(OH)2溶液混合,反应生成硫酸钡和氢氧化镁沉淀,正确的反应为:Ba2++SO42-+Mg2++2OH-═Mg(OH)2↓+BaSO4↓,故(1)错误;
(2)用惰性电极电解Na2S溶液,反应生成硫单质、氢气和氢氧化钠,反应的离子方程式为:S2-+2H2O$\frac{\underline{\;电解\;}}{\;}$S↓+H2↑+2OH-,故(2)正确;
(3)往FeBr2溶液中通入过量C12,二价铁离子、溴离子都被氧化,正确的离子方程式为:3Cl2+2Fe2++4Br-═2Fe3++6Cl-+2Br2,故(3)错误;
(4)FeCl3溶液中撒入CaCO3粉末有气泡产生,反应的离子方程式为:2Fe3++3CaCO3+3H2O═2Fe(OH)3↓+3Ca2++3CO2↑,故(4)正确;
(5)氨水吸收少量的二氧化硫,反应生成亚硫酸铵,正确的离子方程式为:2NH3•H2O+SO2═2NH4++SO32-,故(5)错误;
(6)电解池中,金属铜作阳极时,铜电极本身失去电子,阴极是盐酸中的氢离子放电,反应的电解反应为:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cu2+,故(6)正确;
(7)用石墨作电极电解AlCl3溶液生成氢氧化铝、氢气和氯气,离子方程式:2Al3++6Cl-+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑+3Cl2↑,故(7)错误;
(8)Na2O2加入到足量H218O中,过氧化钠既做氧化剂又做还原剂,正确的离子方程式为:2Na2O2+2H218O═4Na++418OH-+O2↑,故(8)错误;
根据分析可知,正确的离子方程式有3个,
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

| 实验方案 | 实验现象 |
| ①将新制氯水滴加到NaBr溶液中,振荡后加入适量CCl4溶液,振荡,静置 | A.浮在水面上,熔成小球,四处游动,随后消失 |
| ②将一小块金属钠放入冷水中 | B.分层,上层无色,下层紫色 |
| ③将溴水滴加到NaI溶液中,振荡后加入适量CCl4溶液,振荡,静置 | C.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D.分层,上层无色,下层红棕色 |
(1)实验目的:探究同主族元素性质的相似性和递变性.
(2)实验用品:①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol•L-1NaBr溶液、0.1mol•L-1NaI溶液、CCl4溶液等.
②仪器:试管、烧杯、胶头滴管、镊子、小刀、玻璃片等.
(3)实验内容(请把表中与实验方案对应的实验现象的标号和化学方程式补写完整):
| 实验方案 | 实验现象 | 化学方程式 |
| ① | D | Cl2+2NaBr═2NaCl+Br2 |
| ② | A | 2Na+2H2O═2NaOH+H2↑ |
| ③ | B | Br2+2NaI═2NaBr+I2 |
| ④ | C | 2K+2H2O═2KOH+H2↑ |
| A. | 46g乙醇中存在的共价键总数为8NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
| 选项 | 实验操作现象 | 实验结论 |
| A | 向取了少量的KClO3晶体的试管中加入适量的蒸馏水,再向其中加入硝酸酸化的AgNO3溶液 | 该方法可以检验KClO3中是否含有氯元素 |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色,将褪色溶液加热,品红颜色复原 | 该气体一定是SO2 |
| D | 向AgNO3溶液中加入足量的NaCl溶液,再加入KI溶液,再加入Na2S溶液,先后有白色沉淀变为黄色沉淀,最后又白色变为黑色沉淀 | Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S) |
| A. | A | B. | B | C. | C | D. | D |
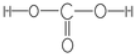 .
.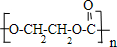 +nH2O.
+nH2O.