题目内容
14.-定条件下,合成氨反应为:N2(g)+3H2(g)?2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时 间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响下列说法正确的是( )
| A. | 升高温度,该反应的平衡常数增大 | |
| B. | 由图2信息,10 min内该反应的平均速率v(H2)=0.09 mol•L-1•min-1 | |
| C. | 由图2信息,从11 min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d | |
| D. | 图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
分析 A.由图可知,反应物总能量大于生成物总能量,该反应为放热反应;
B.10 min内该反应的平均速率v(N2)=$\frac{\frac{0.6mol-0.3mol}{2L}}{10min}$=0.015 mol•L-1•min-1,结合速率之比等于化学计量数之比计算;
C.从11 min起其它条件不变,压缩容器的体积,平衡正向移动,n(N2)减小;
D.a、b、c三点均在同一曲线上,氢气的物质的量越大,氮气的转化率越大.
解答 解:A.由图可知,反应物总能量大于生成物总能量,该反应为放热反应,则升高温度,平衡逆向移动,平衡常数K减小,故A错误;
B.10 min内该反应的平均速率v(N2)=$\frac{\frac{0.6mol-0.3mol}{2L}}{10min}$=0.015 mol•L-1•min-1,由速率之比等于化学计量数之比可知,v(H2)=0.045 mol•L-1•min-1,故B错误;
C.从11 min起其它条件不变,压缩容器的体积,平衡正向移动,n(N2)减小,可知n(N2)的变化曲线为d,故C正确;
D.温度、体积不变时,氢气的物质的量越大,氮气的转化率越大,a、b、c三点均在同一曲线上,均为平衡状态点,则反应物N2的转化率最高的是c点,故D错误;
故选C.
点评 本题考查物质的量随时间的变化曲线、反应热与焓变,为高频考点,把握图象分析、反应中能量变化、平衡移动为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列物质分类正确的是( )
| A. | CuO、Na2O和Na2O2都是碱性氧化物 | |
| B. | SO2能与碱反应生成盐和水,因此SO2属于酸性氧化物 | |
| C. | NH4Cl不含金属阳离子,不属于盐 | |
| D. | 金属氧化物都是碱性氧化物 |
2.乙酸正丁酯是无色透明有愉快果香气味的液体,可用乙酸和正丁醇制备.反应的化学方程式如下:
CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
发生的副反应如下:

有关化合物的物理性质见下表:
已知:乙酸正丁酯、正丁醇和水组成三元共沸物恒沸点为90.7℃.
合成:
方案甲:采用装置甲(分水器预先加入水,使水面略低于分水器的支管口),在干燥的50mL圆底烧瓶中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸和2g沸石,摇匀.按下图安装好带分水器的回流反应装置,通冷却水,圆底烧瓶在电热套上加热煮沸.在反应过程中,通过分水器下部的旋塞分出生成的水(注意保持分水器中水层液面仍保持原来高度,使油层尽量回到圆底烧瓶中).反应基本完成后,停止加热.
方案乙:采用装置乙,加料方式与方案甲相同.加热回流,反应60min后停止加热.

提纯:甲乙两方案均采用蒸馏方法.操作如下:

请回答:
(1)a处水流方向是进水(填“进水”或“出水”),仪器b的名称(直形)冷凝管;
(2)合成步骤中,方案甲监控酯化反应已基本完成的标志是分水器中水不再生成或分水器中的水层不再增加时;
(3)提纯过程中,步骤②是为了除去有机层中残留的酸,检验有机层已呈中性的操作是用玻璃棒蘸取有机层,点在pH试纸上,与标准比色卡对照,读取pH值判断;步骤③的目的是除去溶于酯中的少量无机盐;
(4)下列有关洗涤过程中分液漏斗的使用正确的是BC
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.洗涤时振摇放气操作应如图戊所示
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
D.洗涤完成后,先放出下层液体,然后继续从下口放出有机层置于干燥的锥形瓶中
(5)按装置丙蒸馏,最后圆底烧瓶中残留的液体主要是正丁醚;若按图丁放置温度计,则收集到的产品馏分中还含有正丁醇;
(6)实验结果表明方案甲的产率较高,原因是通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
发生的副反应如下:

有关化合物的物理性质见下表:
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
合成:
方案甲:采用装置甲(分水器预先加入水,使水面略低于分水器的支管口),在干燥的50mL圆底烧瓶中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸和2g沸石,摇匀.按下图安装好带分水器的回流反应装置,通冷却水,圆底烧瓶在电热套上加热煮沸.在反应过程中,通过分水器下部的旋塞分出生成的水(注意保持分水器中水层液面仍保持原来高度,使油层尽量回到圆底烧瓶中).反应基本完成后,停止加热.
方案乙:采用装置乙,加料方式与方案甲相同.加热回流,反应60min后停止加热.

提纯:甲乙两方案均采用蒸馏方法.操作如下:

请回答:
(1)a处水流方向是进水(填“进水”或“出水”),仪器b的名称(直形)冷凝管;
(2)合成步骤中,方案甲监控酯化反应已基本完成的标志是分水器中水不再生成或分水器中的水层不再增加时;
(3)提纯过程中,步骤②是为了除去有机层中残留的酸,检验有机层已呈中性的操作是用玻璃棒蘸取有机层,点在pH试纸上,与标准比色卡对照,读取pH值判断;步骤③的目的是除去溶于酯中的少量无机盐;
(4)下列有关洗涤过程中分液漏斗的使用正确的是BC
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.洗涤时振摇放气操作应如图戊所示
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
D.洗涤完成后,先放出下层液体,然后继续从下口放出有机层置于干燥的锥形瓶中
(5)按装置丙蒸馏,最后圆底烧瓶中残留的液体主要是正丁醚;若按图丁放置温度计,则收集到的产品馏分中还含有正丁醇;
(6)实验结果表明方案甲的产率较高,原因是通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
4.已知工业上真空炼铷的反应方程式为:2RbCl+Mg $\stackrel{熔融}{?}$MgCl2+2Rb(g),对于此反应,能够进行正确解释的是( )
| A. | 铷比镁金属性强 | |
| B. | 氯化镁比氯化铷难溶 | |
| C. | 高温下,镁离子得电子能力比铷离子弱 | |
| D. | 铷的沸点比镁低,当把铷蒸气抽走时,平衡向右反应方向移动 |
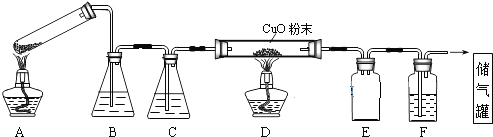

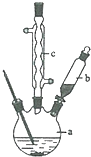 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: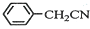 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$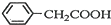 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→(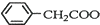 )2Cu+H2O
)2Cu+H2O