题目内容
5.草酸晶体的组成可表示为H2C2O4•xH2O.实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4•xH2O $\frac{\underline{\;\;△\;\;}}{\;}$CO+CO2+(x+1)H2O.下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题.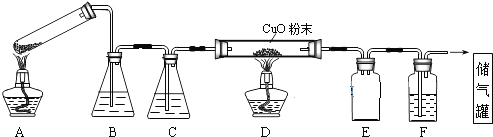
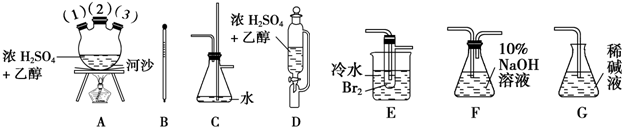
(1)A装置为加热分解草酸的装置,该装置错误是试管口应向下倾斜,C装置中盛放的试剂是浓硫酸,E装置的作用是安全瓶(或防倒吸).
(2)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯.这4步操作由先到后的顺序为①③④②(填序号).点燃D处酒精灯前必须要进行的操作名称是验纯.
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值.
实验步骤:准确称取1.26g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL.滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O.
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有100mL容量瓶、胶头滴管.
②x=2.
分析 (1)给试管中的固体加热时,试管口应该稍稍向下倾斜;根据图示装置及实验目的可知:B为澄清石灰水,目的是除去混合气体中二氧化碳,C为浓硫酸,目的是干燥CO气体;D中氧化铜与一氧化碳反应制取铜;E为安全瓶,起到防止倒吸的作用;F为澄清石灰水,除去二氧化碳气体,最后收集CO气体;
(2)纯度不足时一氧化碳气体会发生爆炸,所以先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时,应该先熄灭D处酒精灯,然后再熄灭A处酒精灯;
(3)①根据配制一定物质的量浓度的溶液的方法判断需要的仪器;
②根据反应原理及高锰酸钾的物质的量计算出该草酸晶体中含有草酸的物质的量、质量,再计算出结晶水的物质的量,最后计算出x;
解答 解:(1)反应中有水生成,容易导致试管炸裂,所以A装置中试管口应向下倾斜;B为澄清石灰水,目的是除去混合气体中二氧化碳,C为浓硫酸,目的是干燥CO气体;D中CuO与CO反应制取Cu;E为安全瓶,起到防止倒吸的作用;F为澄清石灰水,除去二氧化碳气体,
故答案为:试管口应向下倾斜;浓硫酸;安全瓶(或防倒吸);
(2)CO气体的纯度不足时会发生爆炸现象,所以应该先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时恰好相反,先熄灭D处酒精灯,然后再熄灭A处酒精灯,所以正确的操作方法为:①③④②;避免发生爆炸现象,所以点燃D处酒精灯前必须要进行检验CO纯度,
故答案为:①③④②;验纯;
(3)①配制草酸溶液除需要玻璃棒、烧杯,配制100mL溶液需要选用100mL容量瓶,定容时还需要胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②16mL 0.0500mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.0500mol/L×0.016L=0.0008mol,100mL该醋酸溶液能够消耗高锰酸钾的物质的量为:0.0008mol×$\frac{100ml}{20ml}$=0.004mol,根据反应2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O可知1.17g样品中含有草酸的物质的量为:0.004mol×$\frac{5}{2}$=0.01mol,草酸的质量为:90g/mol×0.01mol=0.9g,含有结晶水的物质的量为:$\frac{1.26g-0.9g}{18g/mol}$=0.02mol,则该草酸晶体中x=$\frac{0.02mol}{0.01mol}$=2,
故答案为:2;
点评 本题考查了探究物质组成、称量物质含量的方法,题目难度中等,熟练掌握化学实验基本操作方法为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力,是一道质量较好的题目.

 名校课堂系列答案
名校课堂系列答案| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| C. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-数为NA | |
| D. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA |
| A. | 铝热反应是炼铁最常用的方法 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可提高空气质量 | |
| D. | 袋装食品常用生石灰包作为食品的抗氧化剂 |
| A. | “水乳交融,火上浇油”前者包含物理变化,后者包含化学变化 | |
| B. | “滴水石穿.绳锯木断”不包含化学变化 | |
| C. | “蜡炬成灰泪始干”包含的是物理变化 | |
| D. | 石灰吟中“烈火焚烧若等闲”指的是加热,不包含化学变化 |
㈠鉴别NaCl和NaNO2
1测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).NaNO2溶液中c(HNO2)=c(OH-)-c(H+)(用溶液中其它离子的浓度关系式表示).
2沉淀法
取2mL0.1mol/L两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液.两支试管均产生白色沉淀.分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解.该温度下 Ksp(AgNO2)=2×10-8;
Ksp(AgCl)=1.8×10-10则反应AgNO2(s)+Cl-(aq)?AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{1000}{9}$(计算结果写成分数)
(二)实验室可用如下装置(略去部分夹持仪器)制备亚硝酸钠.
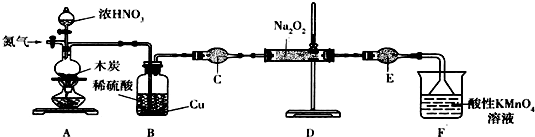
已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3$\frac{\underline{\;加热\;}}{\;}$CO2+4NO2+2H2O.装置B 的作用是将NO2 气体转变为NO,为后面反应提供原料.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(三)测定亚硝酸钠的含量
称取4.000g制取样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 次数 | 2 | 3 | ||
| KMnO体积/m | 20.60 | 20.02 | 20.00 | 9.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O
③根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.(结果保留两位小数)
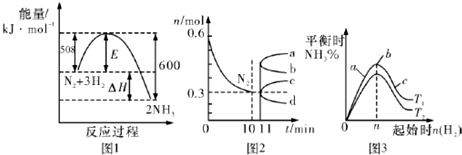
| A. | 升高温度,该反应的平衡常数增大 | |
| B. | 由图2信息,10 min内该反应的平均速率v(H2)=0.09 mol•L-1•min-1 | |
| C. | 由图2信息,从11 min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d | |
| D. | 图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |