题目内容
5.NO是大气污染物之一,目前有一种治理方法是在400℃左右,在催化剂存在下,用氨把NO还原为N2和H2O.请写出该反应的化学方程式4NH3+6NO$\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O.有人设想用天然气代替NH3处理NO:
(1)如能.请写出相关的化学方程4NO+CH4$\frac{\underline{\;催化剂\;}}{\;}$CO2+2N2+2H2O;
(2)如不能.请说明原因、.
分析 根据题意,在400℃左右、有催化剂存在的条件下,用氨气把NO还原为氮气和水,反应的化学方程式即可;
天然气的主要成分是CH4,CH4的还原性强于NH3,甲烷和一氧化氮反应生成二氧化碳、氮气、水,据此分析解答.
解答 解:在400℃左右、有催化剂存在的条件下,用氨气把NO还原为氮气和水,反应的化学方程式为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O.
天然气的主要成分是CH4,CH4的还原性强于NH3,则CH4可与NO发生如下反应:4NO+CH4$\frac{\underline{\;催化剂\;}}{\;}$CO2+2N2+2H2O,相同质量的CH4和NH3还原NO,CH4还原的NO多,且天然气资源丰富,可使生产成本降低,
故答案为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O;4NO+CH4$\frac{\underline{\;催化剂\;}}{\;}$CO2+2N2+2H2O.
点评 本题综合考查含氮化合物知识,侧重于学生的分析能力和元素化合物知识的理解和运用的考查,为高考高频考点,注意氧化还原知识在该题中的分析应用,题目难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
16.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和C60的熔化 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 液溴和液汞的汽化 |
20.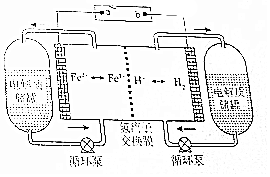 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
12.为吸收多余的氯气,防止污染环境,下列试剂中最合适的是( )
| A. | 烧碱溶液 | B. | 饱和石灰水 | C. | 自来水 | D. | 食盐水 |
9.某温度下,某碳酸钠饱和溶液质量分数为a%,;若分别向其中加入m molNa2CO3•5H2O和n mol Na2CO3,可析出相同质量的晶体Na2CO3•10H2O.则下列叙述正确的是( )
| A. | a可能是40,m>n | B. | a可能是40,m=n | C. | a可能是30,m>n | D. | a可能是30,m<n |