题目内容
5.某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题: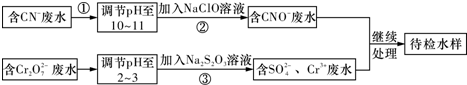
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:CN-+ClO-═CNO-+Cl-.
(2)步骤③的反应为S2O32-+Cr2O72-+H+-→SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移2.4mol e-.
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去.
(4)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀.蓝色沉淀转化成黑色沉淀的离子方程是:Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
分析 由流程可知,CN-废水调整溶液pH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液pH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,处理的废水继续处理得到待测水样;
(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(2)Cr元素的化合价由+6价降低为+3价,结合化合价计算转移电子;
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去;
(4)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生沉淀的转化.
解答 解:(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,离子反应为:CN-+ClO-═CNO-+Cl-,故答案为:CN-+ClO-═CNO-+Cl-;
(2)步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:2.4;
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去,故调节废水pH,使其转化成Cr(OH)3沉淀除去,
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)蓝色沉淀为Cu(OH)2,CuS(s)比Cu(OH)2(s)更难溶,发生了沉淀的转化,涉及的离子反应方程式为Cu2++2OH-═Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),
故答案为:Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
点评 本题以污水处理流程综合考查混合物分离提纯,为高频考点,涉及氧化还原反应、离子方程式、水溶液中的离子平衡、沉淀溶解平衡等电解质溶液的相关知识,综合性较强,侧重考查学生的知识运用能力、灵活分析处理实际问题的能力,题目难度中等.

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | Na2O2 | B. | CO2 | C. | NaOH | D. | H2O2 |
| A. | W与氢形成的原子比为1:1的化合物有多种 | |
| B. | X的氢化物只含有极性共价键 | |
| C. | Y单质可通过电解Y的氯化物获得 | |
| D. | W与Z形成化合物WZ2中各原子均满足8电子稳定结构 |
| A. | 1 mol任何气体在标准状况下所占体积都约是22.4 L | |
| B. | 标准状况时,氧气的体积约是22.4 L | |
| C. | 1 mol任何气体的体积都约是22.4 L | |
| D. | 1 mol氢气和1 mol水含相同分子数,标准状况下体积都约是22.4 L |
| A. | 反应容器中,气体物质的总质量不再变化 | |
| B. | 反应容器中,各物质的量不随时间变化 | |
| C. | 反应容器中,压强不随时间改变而改变 | |
| D. | 反应容器中,气体的密度不再改变 |