题目内容
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4L的H2O中含有的分子数为NA |
| B、常温常压下,48g O3与O2混合气体中含氧原子数为3NA |
| C、12g Mg与足量稀盐酸反应转移的电子数为2NA |
| D、1L 1mol?L-1Na2CO3溶液中含有的钠离子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、水在标准状况不是气体;
B、氧元素守恒,依据n=
计算氧原子物质的量得到氧原子数
C、依据n=
计算物质的量,结合镁的原子结构计算转移电子数;
D、依据n-CV计算溶质物质的量,计算得到钠离子数;
B、氧元素守恒,依据n=
| m |
| M |
C、依据n=
| m |
| M |
D、依据n-CV计算溶质物质的量,计算得到钠离子数;
解答:
解:A、标准状况下,水在标准状况不是气体,22.4L的H2O物质的量不是1mol,故A错误;
B、48g O3与O2混合气体中氧原子物质的量=
=3mol,含氧原子数为3NA,故B正确;
C、12g Mg物质的量为0.5mol,镁原子最外层电子为2,与足量稀盐酸反应转移的电子数为NA,故C错误;
D、1L 1mol?L-1Na2CO3溶液中溶质物质的量为1mol,含有的钠离子数为2NA,故D错误;
故选B.
B、48g O3与O2混合气体中氧原子物质的量=
| 48g |
| 16g/mol |
C、12g Mg物质的量为0.5mol,镁原子最外层电子为2,与足量稀盐酸反应转移的电子数为NA,故C错误;
D、1L 1mol?L-1Na2CO3溶液中溶质物质的量为1mol,含有的钠离子数为2NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的分析判断,主要考查气体摩尔体积的条件应用,盐类水解的分析应用,氧化还原反应电子转移的计算应用是解题关键,题目难度中等.

练习册系列答案
相关题目
对于常温下0.1mol?L-1氨水和0.1mol?L-1醋酸,下列说法正确的是( )
| A、0.1mol?L-1氨水,溶液的pH=13 |
| B、0.1mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C、0.1mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D、0.1mol?L-1醋酸与0.1mol?L-1 NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
 如图,其电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则下列说法正确的是( )
如图,其电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则下列说法正确的是( )| A、充电时有CH3OH生成的电极为阳极 |
| B、放电时电解质溶液的pH逐渐增大 |
| C、放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、充电时每生成1 mol CH3OH转移12mol电子 |
下列各组物质中,互为同分异构体的是( )
| A、冰和水 |
| B、氧气和臭氧 |
| C、1H与3H |
| D、CH3CH20H和CH30CH3 |
下列离子方程式书写正确的是( )
| A、铁溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | ||||
| B、二氧化硫与足量烧碱溶液反应:S02+20H-=S032-+H20 | ||||
| C、醋酸溶液与氢氧化钠溶液反应:H++OH-=H20 | ||||
D、浓盐酸与MnO2反应制Cl2:Mn02+2H++2C1-
|
X、Y、Z、W是前20号元素,原子序数依次增大.X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子的核外电子排布与氖原子相同,W元素为金属,它的某种化合物可用于烟气脱硫.下列说法错误的是( )
| A、X、Y形成的化合物中可能含有双键 |
| B、X单质和Z单质在暗处能剧烈反应 |
C、W元素与Z元素形成的化合物用电子式表示形成过程为: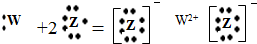 |
| D、XZ的沸点在与Z同族的其它X的化合物中最高 |
下面各装置图能达到实验目的是( )
A、 实验Ⅰ量取20.0mL的H2SO4待测液放入锥形瓶中 |
B、 实验Ⅱ用CaC2和饱和食盐水反应制取C2H2 |
C、 实验Ⅲ制取氨气 |
D、 实验Ⅳ褪色证明了乙烯可以与溴发生加成反应 |
