题目内容
14.运用所学知识,回答下列问题.(1)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O,工艺师常用氢氟酸(填物质名称)来雕刻玻璃.
(2)向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色.该反应的离子方程式为4I-+2Cu 2+=2CuI↓+I2;取一定量上述反应后的上层棕色清液于一支试管中,加入一定量的苯,振荡,此时观察到的现象是溶液分层,上层溶液为紫红色.
(3)电子工业常用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,工程师欲从制造印刷电路板的工业废水中回收铜,并获得FeCl3溶液,设计如下方案:
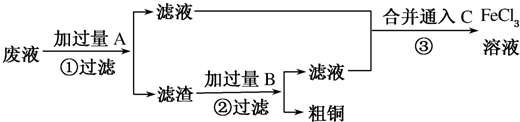
①滤渣的成分为Fe、Cu.(填化学式)
②加过量B发生反应的离子方程式为Fe+2H+=Fe2++H2↑.
③通入C发生反应的化学方程式为Cl2+2FeCl2=FeCl3.
分析 (1)二氧化硅与氢氧化钠反应生成硅酸钠和水;氢氟酸能够与二氧化硅反应生成四氟化硅和水;
(2)向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色说明有I2生成,反应方程式为2CuSO4+4KI=I2+2CuI↓+2K2SO4;
(3)制取的是氯化铁溶液,金属A是铁;滤液是氯化亚铁溶液;加入的铁过量,滤渣是铁和铜;制取的是氯化铁,溶解铁,B加入应该是盐酸,滤液为氯化亚铁,氯化亚铁与氯气反应生成氯化铁,所以C为氯气.
解答 解:(1)二氧化硅与氢氧化钠反应生成硅酸钠和水,化学方程式:SiO2+2NaOH═Na2SiO3+H2O;氢氟酸能够与二氧化硅反应生成四氟化硅和水,能够腐蚀玻璃,可用来雕刻玻璃;
故答案为:SiO2+2NaOH═Na2SiO3+H2O;氢氟酸;
(2)向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色说明有I2生成,反应方程式为2CuSO4+4KI=I2+2CuI↓+2K2SO4,离子方程式为:4I-+2Cu 2+=2CuI↓+I2,苯的碘溶液为紫红色,苯的密度比水小,故答案为:4I-+2Cu 2+=2CuI↓+I2;溶液分层,上层溶液为紫红色;
(3)制取的是氯化铁溶液,金属A是铁;滤液是氯化亚铁溶液;加入的铁过量,滤渣是铁和铜;制取的是氯化铁,溶解铁,B加入应该是盐酸,滤液为氯化亚铁,氯化亚铁与氯气反应生成氯化铁,所以C为氯气,
①滤渣的化学式为Fe、Cu,
故答案为:Fe、Cu;
②加过量盐酸发生反应的离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
③是将亚铁离子氧化成三价铁离子,反应方程式是:2FeCl2+Cl2=2FeCl3,
故答案为:2FeCl2+Cl2=2FeCl3.
点评 本题考查了硅、铜及其化合物以及物质分离、提纯的实验方案设计,熟悉硅酸盐的概念、二氧化硅的性质是解题关键,题目难度不大.

| A. | 26 g | B. | 28 g | C. | 29.5 g | D. | 29.1 g |
| A. | HCl | B. | NaOH | C. | HF | D. | CaO |
| A. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| B. | 用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量 | |
| C. | 牛奶久置变质腐败 | |
| D. | 氧化铜固体加入稀盐酸中,完全溶解 |
| A. | HCl | B. | NaOH | C. | CaCl2 | D. | N2 |
| A. | 大多数能在一定条件下发生水解反应 | |
| B. | 都是天然高分子化合物 | |
| C. | 组成元素均为C、H、O | |
| D. | 蛋白质遇饱和硫酸铵溶液会凝聚,失去生理功能 |
| A. | 3g H2 | B. | 标准状况下的11.2 L Cl2 | ||
| C. | 1molCO | D. | 98g 纯H2SO4 |
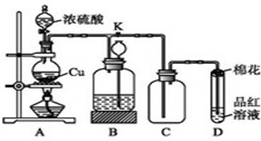 某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验. 甲同学取ag Cu 片和12ml 18mol/L浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余.
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验. 甲同学取ag Cu 片和12ml 18mol/L浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余.