题目内容
下列反应的离子方程式书写正确的是( )
| A、稀醋酸与氢氧化钠溶液的反应:H++OH-═H2O |
| B、铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ |
| C、氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 |
| D、碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═H2O+CO2↑ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.醋酸在离子反应中保留化学式;
B.反应生成硝酸铜、NO和水;
C.电子、电荷不守恒;
D.反应生成氯化钠、水、二氧化碳.
B.反应生成硝酸铜、NO和水;
C.电子、电荷不守恒;
D.反应生成氯化钠、水、二氧化碳.
解答:
解:A.稀醋酸与氢氧化钠溶液的反应的离子反应为CH3COOH+OH-═H2O+CH3COO-,故A错误;
B.铜粉与稀硝酸的反应的离子反应为3Cu+2NO3-+8H+═3Cu2++4H2O+2NO↑,故B错误;
C.氯气与碘化钾溶液的反应的离子反应为Cl2+2I-═2Cl-+I2,故C错误;
D.碳酸钠溶液与足量稀盐酸的反应的离子反应为CO32-+2H+═H2O+CO2↑,故D正确;
故选D.
B.铜粉与稀硝酸的反应的离子反应为3Cu+2NO3-+8H+═3Cu2++4H2O+2NO↑,故B错误;
C.氯气与碘化钾溶液的反应的离子反应为Cl2+2I-═2Cl-+I2,故C错误;
D.碳酸钠溶液与足量稀盐酸的反应的离子反应为CO32-+2H+═H2O+CO2↑,故D正确;
故选D.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,反应:A(g)+3B(g)?2C(g)+D(g)不能表明已达平衡状态的是( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、B的物质的量浓度 |
| D、气体总物质的量 |
下列有机反应属于消去反应的是( )
A、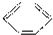 +HONO2 +HONO2
 +H2O +H2O | |||
B、CH3CH3OH+CH3COOH
| |||
C、CH3CH2OH
| |||
| D、BrCH=CHBr+Br2→CHBr2CHBr2 |
已知X,Y,Z和W是短周期元素,其中X+,Y2+,Z-,W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W种元素的描述,正确的是( )
| A、原子半径:X>Y>Z>W |
| B、原子序数:X>Y>Z>W |
| C、原子最外层电子数:Z>W>Y>X |
| D、最高价氧化物对应的水化物都具有酸性 |
下列溶液中,溶质的物质的量浓度为1mol?L-1的是( )
| A、将40g NaOH溶于1L水所得的溶液 |
| B、将0.5mol?L-1的NaNO3溶液100mL加热蒸发掉50g水所得的溶液 |
| C、将23g Na溶于水并配成1L的溶液 |
| D、从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L |

