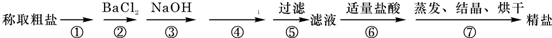题目内容
2.有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )| A. | 4种 | B. | 9种 | C. | 13种 | D. | 15种 |
分析 有机物A的蒸气对氢气同温同压下相对密度为51,则A的相对分子质量为51×2=102,含氧的质量分数为31.7%,则分子中N(O)=$\frac{102×31.7%}{16}$=2,分子中碳、氢元素的原子量之和为102-16×2=70,利用余商法$\frac{70}{14}$=5…0,所以分子式为C5H10O2,能在碱性溶液中发生反应,可能是酸、也可能是酯从而判断同分异构体;
解答 解:有机物X的蒸气相对氢气的密度为51,它的相对分子质量为102,含有的氧原子个数为102×31.7%÷16≈2,所以该有机物的分子式为C5H10O2;能在碱性溶液中发生反应,可能为羧酸,也可能为酯.
C5H10O2属于羧酸的同分异构体为丁烷中的1个H原子被-COOH夺取,即由丁基与-COOH构成,其同分异构体数目与丁基异构数目相等,-C4H9异构体有:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,故C5H10O2属于羧酸的同分异构体有4种;
C5H10O2属于酯的同分异构体
若为甲酸和丁醇酯化,丁醇有4种,可形成4种酯;
若为乙酸和丙醇酯化,丙醇有2种,可形成2种酯;
若为丙酸和乙醇酯化,丙酸有1种,可形成1种酯;
若为丁酸和甲醇酯化,丁酸有2种,可形成2种酯;
C5H10O2属于酯的同分异构体有9种;
所以能在碱性溶液中发生反应的X的同分异构体有13种,故选C.
点评 本题考查有机物分子式的确定、同分异构体书写、官能团的性质等,计算确定有机物的分子式、确定酯的种类是解题的关键,注意掌握官能团的性质.

练习册系列答案
相关题目
12.用标准NaOH溶液滴定未知浓度的盐酸溶液,以测定盐酸的浓度,下列操作使测定结果偏高的是( )
| A. | 未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗 | |
| B. | 装待测液的锥形瓶,洗涤后未干就盛入待测液 | |
| C. | 滴定结束后,用俯视法观察碱式滴定管刻度,其余操作正确 | |
| D. | 滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液 |
17.下列说法正确的是( )
| A. | SiO2与酸、碱均不反应 | |
| B. | NO2溶于水时发生氧化还原反应 | |
| C. | SO2具有氧化性,可用于漂白纸浆 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
7.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是( )
| A. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| B. | 0.1 mol F- 中含有的电子数等于0.9×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 电解饱和食盐水若产生2 g氢气,则转移的电子数目为2×6.02×1023 |
14.对于常温下pH均为4的三种溶液:①盐酸,②CH3COOH溶液,③NH4Cl溶液,下列说法中正确的是( )
| A. | 溶液中由水电离出的c(H+):②>③ | |
| B. | 稀释100倍后溶液的pH:①<③ | |
| C. | 中和相同体积的上述溶液消耗NaOH溶液的体积:①<② | |
| D. | ②和③等体积混合后的溶液:c(CH3COO-)+c(Cl-)=c(NH4+) |
 A图是物质M和N的溶解度曲线.B图中甲、乙试管分别盛 有M、N的饱和溶液,试管底均有未溶解的M、N固体.向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质可能是C
A图是物质M和N的溶解度曲线.B图中甲、乙试管分别盛 有M、N的饱和溶液,试管底均有未溶解的M、N固体.向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质可能是C  我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):