题目内容
10.请写出下列反应的化学方程式:①氯乙烷制乙烯:CH3CH2Cl+NaOH $→_{△}^{醇}$CH2=CH2↑+NaCl+H2O
②乙醇制乙烯:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
③苯酚钠溶液通入少量CO2:C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3
④丙醛与新制的氢氧化铜悬浊液反应:2Cu(OH)2+CH2OH(CHOH)4CHO$\stackrel{△}{→}$CH2OH(CHOH)4COOH+Cu2O↓+2H2O.
分析 ①发生消去反应生成乙烯;
②发生消去反应生成乙烯;
③反应生成苯酚和碳酸氢钠;
④反应生成丙酸铵、氧化亚铜、水.
解答 解:①发生消去反应生成乙烯,反应为CH3CH2Cl+NaOH $→_{△}^{醇}$CH2=CH2↑+NaCl+H2O,故答案为:CH3CH2Cl+NaOH $→_{△}^{醇}$CH2=CH2↑+NaCl+H2O;
②发生消去反应生成乙烯,反应为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
③反应生成苯酚和碳酸氢钠,反应方程式为C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3,故答案为:C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3;
④反应生成丙酸、氧化亚铜、水,反应为2Cu(OH)2+CH2OH(CHOH)4CHO$\stackrel{△}{→}$CH2OH(CHOH)4COOH+Cu2O↓+2H2O,
故答案为:2Cu(OH)2+CH2OH(CHOH)4CHO$\stackrel{△}{→}$CH2OH(CHOH)4COOH+Cu2O↓+2H2O.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,
若a=7(填“>”、“<”或“=”),则HA为强酸;
若a>7(填“>”、“<”或“=”),则HA为弱酸.
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是C
A.前者大 B.后者大C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是弱酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
| 实验 编号 | HA物质的量 浓度(mol• L-1) | NaOH物质的 量浓度(mol• L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其他组的实验结果,单从甲组情况分析,
若a=7(填“>”、“<”或“=”),则HA为强酸;
若a>7(填“>”、“<”或“=”),则HA为弱酸.
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是C
A.前者大 B.后者大C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是弱酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
1.分子式为C7H12O4,其中只含二个-COOCH3基团的同分异构体(不考虑手性异构)共有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
18.某气态烃在密闭容器中与O2恰好完全反应,反应后恢复至原室温,测得气体体积为原来的 1/2,则该烃可能是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
5.下列说法错误的是( )
| A. | 化学反应中的能量变化都表现为热量变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 外界条件与反应是放热还是吸热没有必然联系 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
15.在一定条件下,将A和B各0.32mol充人10L的恒容密闭容器中,发生如下反应:A(g)+B(g)?2C(g);△H<0.反应过程中测定的数据如表,则下列说法正确的是( )
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 其他条件不变,向平衡体系中再充入0.32mol A,再达平衡时,B的转化率增大 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正) | |
| C. | 其他条件不变,起始时向容器中充入各0.64mol A和B,平衡时n(C)<0.48mol | |
| D. | 反应前2 min的平均速率v(C)=0.004 mol•(L•min)-1 |
2.有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
| A. | 4种 | B. | 9种 | C. | 13种 | D. | 15种 |
19.标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
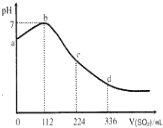

| A. | b 点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氧硫酸更弱的酸 | |
| C. | 原H2S溶液的物质的量浓度为0.05mol•L-1 | |
| D. | ab段反应是:SO2+2H2S═3S↓+2H2O |
20.某气体在标准状况下的密度是1.25克/升,该气体的相对分子质量为( )
| A. | 26 | B. | 28 | C. | 30 | D. | 32 |