题目内容
12. 我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):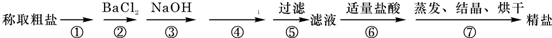
(1)第①步操作的名称是溶解,第②步判断BaCl2已过量的方法是取第②步后的上层溶液1-2滴于点滴板上,再滴入1-2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量.
(2)第④步加入试剂的化学式为Na2CO3,相关的离子方程式是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓.
(3)第⑤步操作所需玻璃仪器的名称是漏斗、,玻璃棒、烧杯.
(4)若第⑤步、第⑥步顺序颠倒,将对实验结果产生影响,其原因是在此酸性条件下会有部分沉淀溶解,从而影响制得精盐的纯度.
(5)为测定精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,如图是该同学转移溶液的示意图,改正图中的错误未用玻璃棒引流,未采用250mL容量瓶.
(6)溶液配制过程中的下列操作会导致浓度偏低的是A、B、C.
A.未洗涤烧杯和玻璃棒
B.称量时被称量物与砝码的位置放颠倒了
C.定容时仰视刻度线
D.定容后经上下颠倒摇匀,静置后液面低于刻度线.
分析 由流程可知,①为溶解,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后⑦蒸发结晶(剩余少量液体停止加热)得到NaCl,据此进行解答.
(1)在粗盐提纯之前要先将粗盐溶解于水中,根据钡离子和硫酸根离子会生成硫酸钡沉淀进行分析;
(2)④中加碳酸钠,碳酸根离子和钡离子、钙离子反应生成沉淀;
(3)根据过滤操作的原理、使用的仪器进行分析解答即可;
(4)盐酸可以将沉淀氢氧化镁、氢氧化铁、碳酸钙等溶解;
(5)实验室没有150mL容量瓶,应用250mL,转移溶液时要用玻璃棒引流;
(6)分析操作对溶质的物质的量或对溶液的体积的影响,根据C=$\frac{n}{V}$计算不当操作对n或V的影响,如果n偏小或V偏大,则所配制溶液浓度偏低.
解答 解:(1)在粗盐提纯之前要先将粗盐溶解于水中,第①步中,操作A是溶解,钡离子和硫酸根离子会生成硫酸钡沉淀,BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为:取第②步后的上层溶液1-2滴于点滴板上,再滴入1-2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:溶解;取第②步后的上层溶液1-2滴于点滴板上,再滴入1-2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)④中加碳酸钠可除去钡离子、钙离子,发生离子反应为:Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓,
故答案为:Na2CO3;Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓;
(3)过滤中用到的仪器有:铁架台、玻璃棒、烧杯、漏斗等,其中用到的三种玻璃仪器是漏斗、烧杯、玻璃棒;烧杯用来盛放液体,漏斗用于过滤,玻璃棒用来引流和搅拌.
故答案为:漏斗、玻璃棒、烧杯;
(4)若先用盐酸再进行操作⑤,盐酸可以将沉淀氢氧化镁、氢氧化铁、碳酸钙等溶解,从而影响制得精盐的纯度,
故答案为:在此酸性条件下会有部分沉淀溶解,从而影响制得精盐的纯度;
(5)实验室没有150mL容量瓶,应用250mL,转移溶液时防止液体溅出,要用玻璃棒引流,
故答案为:未用玻璃棒引流;未采用250mL容量瓶;
(6)A.未洗涤烧杯和玻璃棒,溶质未完全转移到容量瓶中,导致溶质的物质的量偏小,配制溶液的浓度偏低,故A正确;
B.配制250mL 0.2mol/L NaCl需氯化钠质量m=nM=CVM═0.25L×0.2mol/L×58.5g/mol=2.925g≈2.9g,因用到游码,称量时被称量物与砝码的位置放颠倒了,实际称量质量为1.1g,导致溶质的物质的量偏小,配制溶液的浓度偏低,故B正确;
C.定容时仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低,故C正确;
D.定容后经上下颠倒摇匀,静置后液面低于刻度线,一部分溶液留在瓶塞与瓶口之间,经过一段时间液面仍能回到刻度线,无影响,故D错误;
故答案为:A、B、C.
点评 本题考查粗盐的提纯,题目难度中等,把握粗盐提纯流程中的分离方法及发生的离子反应为解答的关键,侧重分析能力及物质除杂的考查.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | 4种 | B. | 9种 | C. | 13种 | D. | 15种 |
| A. | 玻璃碎片 | B. | 破塑料盒 | C. | 纸制包装盒 | D. | 瓜皮果壳 |
| A. | 26 | B. | 28 | C. | 30 | D. | 32 |
| A. | P被氧化 | B. | KOH是还原剂,P是氧化剂 | ||
| C. | P既被氧化又被还原 | D. | KH2PO2是还原产物,PH3是氧化产物 |
| A. | 硅的原子结构示意图: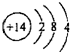 | |
| B. | 乙烯分子比例模型: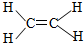 | |
| C. | 二氧化碳分子的电子式: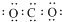 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3═2Fe2++3SO42- |
| A. | 二氧化硫 | B. | 生石灰 | C. | 三氧化硫 | D. | 硫酸 |
| A. | 20mLNH3•H2O与20mLH2SO4 | B. | 10mLCa(HCO3)2与10mLNaOH | ||
| C. | 20mLNaHCO3与10mLCa(OH)2 | D. | 20mLNaHSO4与10mLBa(OH)2 |