题目内容
11.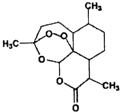 屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )
屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )| A. | 青蒿素的结构中含有过氧键受热容易分解 | |
| B. | 乙醚的结构简式为:CH3OCH3 | |
| C. | 青蒿素溶于热水,所以应加热加快溶解 | |
| D. | 乙醚易溶于水,不能用分液的方法分离 |
分析 由结构筒式可知,分子中含5个环状结构,含-COOC-及1个过氧基团,结合酯的性质及C形成4个化学键来解答.
解答 解:A.青蒿素的结构中含有过氧键,过氧键不稳定,受热容易分解,故A正确;
B.乙醚的结构简式为:CH3CH2OCH2CH3,故B错误;
C.青蒿素中憎水基团对物质溶解性的影响大于亲水基,所以该物质不易溶于水,故C错误;
D.乙醚不易溶于水,可用分液方法分离,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查学生分析判断能力,熟悉常见有机物官能团及其性质,知道常见物质分离和提纯方法.

练习册系列答案
相关题目
2.由二氧化硅制高纯硅的流程如下,下列判断中不正确的是( )

| A. | ①②③均属于氧化还原反应 | B. | H2和HCl均可循环利用 | ||
| C. | SiO2是一种坚硬难熔的固体 | D. | 硅可用于制作光导纤维 |
19.某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
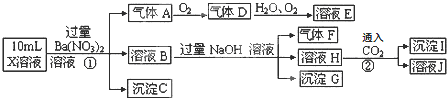
下列说法正确的是( )

下列说法正确的是( )
| A. | 气体F不能与溶液E发生反应 | |
| B. | X中肯定存在Fe2+、Al3+、NH4+、SO42- | |
| C. | X中肯定不存在CO32-、SO32-、Cl- | |
| D. | X中不能确定的离子是Al3+和Cl- |
6.下列物质在生活中应用时,起还原作用的是( )
| A. | 三氯化铁作净水剂 | B. | 硅胶作干燥剂 | ||
| C. | 漂粉精作消毒剂 | D. | 铁粉作食品袋内的脱氧剂 |
16. 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
ⅠCO(g)+2H2(g)?CH3OH(g)△H1
ⅡCO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol
ⅢCO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热.即化学反应热:△H=生成物标准生成热综合-反应物标准生成热总和.
已知四种物质的标准生成热如表:
A.计算△H1=-90.73kJ/molkJ/mol B.△H3>0(填=、<、>)
(2)由甲醇在一定条件下制备甲醚.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).实验数据见表:
下列说法正确的是AD
A.该反应的正反应为放热反应
B.达到平衡时,容器a中的CH3OH体积分数比容器b中的小
C.容器a中反应到达平衡所需时间比容器c中的长
D.若起始时向容器a中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
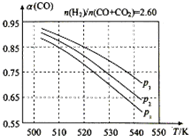
(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.
①α(CO)值随温度升高而减小(填“增大”或“减小”),其原因是升高温度时,反应Ⅰ为放热反应,平衡向左移动,使得体系中CO的量增大;反应Ⅲ为吸热反应,平衡向右移动,CO产生的量也增大;总结果,随温度升高,使CO的转化率降低.
②图中P1、P2、P3的大小关系为P3>P2>P1,其判断理由是相同温度下,由于反应Ⅰ为气体分子数减小的反应,加压有利于提升CO的转化率;而反应Ⅲ为气体分子数不变的反应,产生CO的量不受压强影响;故增大压强,CO的转化率升高.
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是:装置简单,减小了电池的体积;若以硫酸作为电解质其负极反应为:CH3OH-6e-+H2O=CO2+6H+.
 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:ⅠCO(g)+2H2(g)?CH3OH(g)△H1
ⅡCO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol
ⅢCO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热.即化学反应热:△H=生成物标准生成热综合-反应物标准生成热总和.
已知四种物质的标准生成热如表:
| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
(2)由甲醇在一定条件下制备甲醚.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).实验数据见表:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
A.该反应的正反应为放热反应
B.达到平衡时,容器a中的CH3OH体积分数比容器b中的小
C.容器a中反应到达平衡所需时间比容器c中的长
D.若起始时向容器a中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.
①α(CO)值随温度升高而减小(填“增大”或“减小”),其原因是升高温度时,反应Ⅰ为放热反应,平衡向左移动,使得体系中CO的量增大;反应Ⅲ为吸热反应,平衡向右移动,CO产生的量也增大;总结果,随温度升高,使CO的转化率降低.
②图中P1、P2、P3的大小关系为P3>P2>P1,其判断理由是相同温度下,由于反应Ⅰ为气体分子数减小的反应,加压有利于提升CO的转化率;而反应Ⅲ为气体分子数不变的反应,产生CO的量不受压强影响;故增大压强,CO的转化率升高.
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是:装置简单,减小了电池的体积;若以硫酸作为电解质其负极反应为:CH3OH-6e-+H2O=CO2+6H+.
3.在下列各组离子中,能大量共存的且溶液呈无色是( )
| A. | Na+、H+、Al3+、CH3COO- | B. | Mg2+、HCO3-、Ca2+、NO3- | ||
| C. | K+、SO42-、Cl-、Cu2+ | D. | NH4+、Cl-、K+、OH- |
20.当今人类利用的常规能源是( )
| A. | 化石燃料 | B. | 太阳能 | C. | 核能 | D. | 潮汐能 |
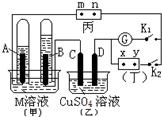 如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:
如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题: