题目内容
5.工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H(CO结构式为C≡O).又知某些化学键的键能(断开 1mol化学键时所需要的最低能量)数值如表:| 化学键 | C-C | C-H | H-H | C-O | C≡0 | H-O |
| 键能(kJ•mol-1) | 348.0 | 413.0 | 436.0 | 358.0 | 1072.0 | 463.0 |
分析 依据化学反应的焓变=反应物总键能-生成物总键能;该反应存在限度,不可能完全转化.
解答 解:制CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H═1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH3OH小于1mol,所以放出的热量小于116 kJ,
故答案为:-116 kJ•mol-1;<.
点评 本题主要考查了有关反应热的计算,掌握热化学方程式的意义是解答关键,题目难度不大,注意知识的运用.

练习册系列答案
相关题目
15.1L烷烃A的蒸汽完全燃烧时,生成同温同压下15L水蒸气,则该烷烃的分子式为( )
| A. | C14H30 | B. | C15H32 | C. | C16H34 | D. | C17H36 |
16.将X逐滴加入到Y中至过量,下列对应关系不正确的是( )
| X | Y | 现象 | 装置 | |
| A | 氯水 | 石蕊 | 溶液先变红后褪色 |  |
| B | 氨水 | AgNO3溶液 | 先产生沉淀后逐渐溶解 | |
| C | NaOH溶液 | AlCl3溶液 | 产生白色沉淀且不消失 | |
| D | 双氧水 | 酸性淀粉KI溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
13.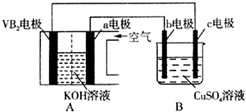 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )| A. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2为负极,电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ | |
| C. | 电池内部OH-移向a电极,溶液pH减小 | |
| D. | 忽略溶液体积变化,电解后B装置中溶液的pH为1 |
10.下列装置能达到实验目的是( )
| A. |  比较二氧化锰和氧化镁的催化效果 | B. |  干燥收集氯气 | ||
| C. |  比较二氧化锰、氯气、硫的氧化性 | D. |  观察铁的吸氧腐蚀 |
17.硫酸锰是工业上制备二氧化锰活性电极的原料,用软锰矿浊液吸收空气中的SO2,得到的硫酸锰溶液中含有CuSO4、Fe2(SO4)3杂质,向溶液中加入MnCO3,过滤;再加入MnS,过滤,得到MnSO4溶液.已知常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14,Ksp(MnCO3)=2.24×10-11,Ksp[Cu(OH)2)]=2.2×10-20.下列推断不正确的是( )
| A. | 加入碳酸锰的目的是除去Fe3+ | |
| B. | 常温下pH=4时,Fe3+已除尽 | |
| C. | Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=2.73×10-23 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
14.某化合物化学式为HnROm,R元素在化合物中只有一种化合价,则R元素的氧化物化学式为( )
| A. | RO | B. | R2Om | C. | R2Om-n | D. | R2O2m-n |
 .
.