题目内容
13.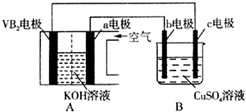 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )| A. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2为负极,电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ | |
| C. | 电池内部OH-移向a电极,溶液pH减小 | |
| D. | 忽略溶液体积变化,电解后B装置中溶液的pH为1 |
分析 硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,电池总反应为:N2H4+O2=N2↑+2H2O,则与负极相连的c为电解池的阴极,铜离子得电子发生还原反应,与氧气相连的b为阳极,氢氧根失电子发生氧化反应,据此分析计算.
解答 解:A、电解过程中,与氧气相连的b为阳极,氢氧根失电子先生成氧气,故A错误;
B、负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O,故B错误;
C、电池内部OH-移向负极b电极,故C错误;
D、当外电路中通过0.04mol电子时,B装置内与氧气相连的b为阳极,氢氧根失电子生成氧气为0.01mol,又共收集到0.448L气体即0.02mol,则阴极也产生0.01moL的氢气,所以溶液中的氢离子物质的量=0.04-0.02=0.02mol,则氢离子的物质的量浓度为=$\frac{0.02}{0.2}$=0.10mol/L,pH=1,故D正确;
故选D.
点评 本题考查原电池及其电解池的工作原理,题目难度不大,本题注意把握电极反应式的书写,利用电子守恒计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列图示与对应的叙述相符的是( )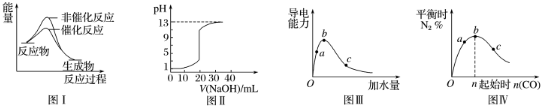

| A. | 图Ⅰ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图Ⅱ表示常温下,0.100 mol•L-1 NaOH溶液滴定20.00 mL 0.100 mol•L-1 HCl溶液所得到的滴定曲线 | |
| C. | 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b | |
| D. | 图Ⅳ表示反应4CO(g)+2NO2(g)?N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2转化率c>b>a |
5.工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H(CO结构式为C≡O).又知某些化学键的键能(断开 1mol化学键时所需要的最低能量)数值如表:
则△H=-116 kJ•mol-1,在相应的反应条件下,将1mol CO(g)与足量H2混合充分反应后,放出或吸收的热量与△H的数值相对大小关系是<.
| 化学键 | C-C | C-H | H-H | C-O | C≡0 | H-O |
| 键能(kJ•mol-1) | 348.0 | 413.0 | 436.0 | 358.0 | 1072.0 | 463.0 |
 .
.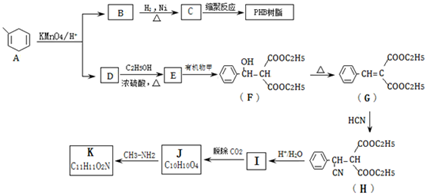
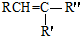 $\stackrel{KMnO_{4}/H+}{→}$RCOOH+
$\stackrel{KMnO_{4}/H+}{→}$RCOOH+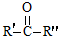
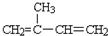 .B的结构简式是
.B的结构简式是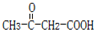 .
.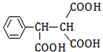 .
.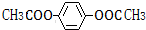 .
.
 .
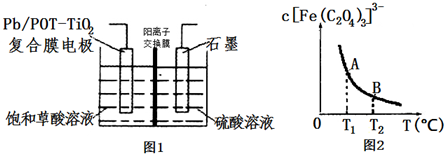
.
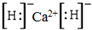 .
.
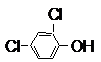 .
. .
.