题目内容
向500mL 2mol/L 的CuSO4溶液中插入一块铁片,反应片刻后取出铁片,经洗涤、烘干,称其质量比原来增重2.0g.下列说法错误的是(设反应后溶液的体积不变)( )
| A、则此过程中参加反应的铁的质量是14g |
| B、析出铜物质的量是0.25mol |
| C、反应后溶液中溶质物质的量浓度:c(CuSO4)=1.5mol/L |
| D、反应后溶液中溶质物质的量浓度:c(FeSO4)=1.5mol/L |
考点:化学方程式的有关计算
专题:计算题
分析:根据发生的反应为Fe+CuSO4═FeSO4+Cu,利用差量法来计算.
解答:
解:铁和硫酸铜反应方程式为:
Fe+CuSO4 ═FeSO4 +Cu△m
56g 1mol 1mol 1mol (64-56)g=8g
m(Fe) n(CuSO4) n(FeSO4 )n(Cu) 2g
A.m(Fe)=
=14g,故A正确;
B.n(Cu)=
=0.25mol,故B正确;
C.n(CuSO4)=
=0.25mol,反应后剩余硫酸铜:0.5L×2mol/L-0.25mol=0.75mol,浓度为:
=1.5mol/L,故C正确;
D.n(FeSO4 )=n(CuSO4)=0.25mol,c(FeSO4)=
=0.5mol/L,故D错误;
故选D.
Fe+CuSO4 ═FeSO4 +Cu△m
56g 1mol 1mol 1mol (64-56)g=8g
m(Fe) n(CuSO4) n(FeSO4 )n(Cu) 2g
A.m(Fe)=
| 56g×2g |
| 8g |
B.n(Cu)=
| 1mol×2g |
| (64-56)g |
C.n(CuSO4)=
| 1mol×2g |
| 8g |
| 0.75mol |
| 0.5L |
D.n(FeSO4 )=n(CuSO4)=0.25mol,c(FeSO4)=
| 0.25mol |
| 0.5L |
故选D.
点评:本题考查学生利用化学反应方程式的计算,明确物质的质量变化及差量法来计算是解答本题的关键,难度不大.

练习册系列答案
相关题目
下列与化学反应能量变化相关的叙述正确的是( )
| A、2CH3CH2OH(l)+6O2(g)═4CO2(g)+6H2O(l)△H=-1367 kJ/mol,可见乙醇燃烧热△H=-1367 kJ/mol |
| B、放热反应的反应速率总是大于吸热反应的反应速率 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
下列离子检验的方法正确的是( )
| A、某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- |
| B、某溶液中先滴加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中有SO42- |
| C、某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ |
| D、某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
用下列实验装置进行相应的实验,能达到实验目的是( )
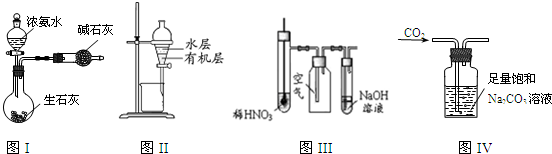

| A、图I所示装置制取干燥的氨气 |
| B、图Ⅱ所示装置用于提取I2的CCl4溶液中的I2 |
| C、图Ⅲ所示装置微热稀HNO3,在广口瓶中可收集NO气体 |
| D、图IV所示装置可用于除去CO2中含有的少量HCl |
下列化学用语正确的是( )
A、水的电子式: |
B、氯化钠的电子式: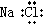 |
| C、KClO3的电离方程式:KClO3=K++Cl-+3O2- |
| D、碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- |
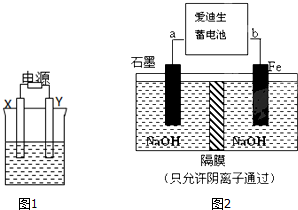 (Ⅰ)如图1,X和Y均为石墨电极:
(Ⅰ)如图1,X和Y均为石墨电极:
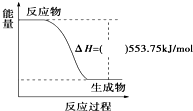 2010年广州亚运会主火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
2010年广州亚运会主火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: