题目内容
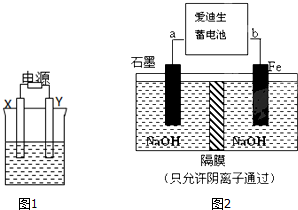 (Ⅰ)如图1,X和Y均为石墨电极:
(Ⅰ)如图1,X和Y均为石墨电极:(1)若电解液为滴有酚酞的饱和食盐水,电解反应的离子方程式为:
(2)若电解液为500mL 含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.
①电解后溶液H+浓度为
②请你推测原溶液中所含的酸根离子可能是
(Ⅱ)爱迪生蓄电池的反应式为:Fe+NiO2+2H20
| 充电 |
| 放电 |
高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂.用如图2的装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是
②写出阳极的电极反应式:
考点:电解原理,化学电源新型电池
专题:电化学专题
分析:(Ⅰ)(1)X和Y均为石墨电极,电解饱和食盐水生成氢氧化钠、氢气和氯气,依据反应过程写出离子方程式;电解过程中阴极负极氢离子得到电子生成氢气,水的电离被破坏,氢氧根离子浓度增大;
(2)①根据电解后所得到的硫酸的量确定氢离子的量,并计算浓度得到溶液pH;电解池中,有金属析出的电极是阴极,根据电解池的工作原理来回答;
②根据硫酸根离子可以和钡离子反应生成白色不溶于硝酸的沉淀来检验;
(Ⅱ)①放电时,铁棒作负极,碳棒作正极,据此判断a的电极;②铁失电子和氢氧根离子生成高铁酸根离子和水;
(2)①根据电解后所得到的硫酸的量确定氢离子的量,并计算浓度得到溶液pH;电解池中,有金属析出的电极是阴极,根据电解池的工作原理来回答;
②根据硫酸根离子可以和钡离子反应生成白色不溶于硝酸的沉淀来检验;
(Ⅱ)①放电时,铁棒作负极,碳棒作正极,据此判断a的电极;②铁失电子和氢氧根离子生成高铁酸根离子和水;
解答:
解:(Ⅰ)(1)电解液为滴有酚酞的饱和食盐水,阴极上是氢离子得电子,生成氢气,氢离子浓度减小,则碱性增强,所以该极区遇到酚酞显示红色,发生反应为:2Cl-+2H2O
2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O
2OH-+Cl2↑+H2↑;阴;
(2)根据溶液和析出金属的颜色可以知道电解的是铜盐溶液,在阳极Y上放出氧气,在阴极X上析出金属铜.
①电解硫酸铜溶液,电极X(阴极)的电极反应方程式是Cu2++2e-═Cu,阳极Y上4OH--4e-═O2↑+2H2O,当生成金属铜为1.6g时,即生成金属铜的物质的量是0.025mol,此时生成硫酸的物质的量是0.025mol,氢离子浓度是
=0.1mol/L,溶液pH=1;电解过程中依据出什么加什么原则,电解过程中析出铜和氧气,所以要使电解后溶液恢复到电解前的状态加入氧化铜或碳酸铜可以恢复溶液浓度;
故答案为:1;CuO或CuCO3;
②根据两极上的现象,可以推知电解的是可溶性的铜盐溶液,阴离子可以是SO42-或NO3?,硫酸根离子的检验方法:取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-,或:硝酸根离子,取少量待测液于试管中,滴加浓硫酸,再撒入铜粉,若有红棕色气体产生,则证明含有硝酸根离子,
故答案为:SO42-或NO3?;取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-或:硝酸根离子,取少量待测液于试管中,滴加浓硫酸,再撒入铜粉,若有红棕色气体产生,则证明含有硝酸根离子;
(Ⅱ)①放电时,铁作负极,碳棒作正极,所以放电时b是负极,a是正极;
故答案为:b;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
| ||
故答案为:2Cl-+2H2O
| ||
(2)根据溶液和析出金属的颜色可以知道电解的是铜盐溶液,在阳极Y上放出氧气,在阴极X上析出金属铜.
①电解硫酸铜溶液,电极X(阴极)的电极反应方程式是Cu2++2e-═Cu,阳极Y上4OH--4e-═O2↑+2H2O,当生成金属铜为1.6g时,即生成金属铜的物质的量是0.025mol,此时生成硫酸的物质的量是0.025mol,氢离子浓度是
| 0.025×2mol |
| 0.5L |
故答案为:1;CuO或CuCO3;
②根据两极上的现象,可以推知电解的是可溶性的铜盐溶液,阴离子可以是SO42-或NO3?,硫酸根离子的检验方法:取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-,或:硝酸根离子,取少量待测液于试管中,滴加浓硫酸,再撒入铜粉,若有红棕色气体产生,则证明含有硝酸根离子,
故答案为:SO42-或NO3?;取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-或:硝酸根离子,取少量待测液于试管中,滴加浓硫酸,再撒入铜粉,若有红棕色气体产生,则证明含有硝酸根离子;
(Ⅱ)①放电时,铁作负极,碳棒作正极,所以放电时b是负极,a是正极;
故答案为:b;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
点评:本题考查了电解原理、原电池工作原理等知识点,明确离子放电顺序是解本题关键,题目难度中等.

练习册系列答案
相关题目
amol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A、(
| ||
B、(
| ||
C、(
| ||
D、(
|
下列有关物质的性质和该性质的应用均正确的是( )
| A、晶体硅具有半导体性质,可用于生产光导纤维 |
| B、H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、二氧化硫具有漂白性,铵不可用于食品漂白 |
向500mL 2mol/L 的CuSO4溶液中插入一块铁片,反应片刻后取出铁片,经洗涤、烘干,称其质量比原来增重2.0g.下列说法错误的是(设反应后溶液的体积不变)( )
| A、则此过程中参加反应的铁的质量是14g |
| B、析出铜物质的量是0.25mol |
| C、反应后溶液中溶质物质的量浓度:c(CuSO4)=1.5mol/L |
| D、反应后溶液中溶质物质的量浓度:c(FeSO4)=1.5mol/L |