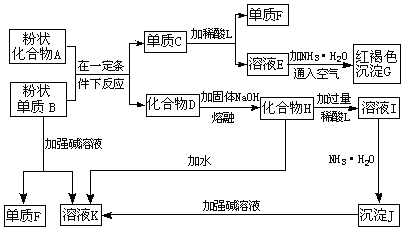
题目内容
1.高炉炼铁的主要反应为:3CO(g)+Fe2O3(s)?3CO2(g)+2Fe(s),已知该反应在不同温度下的平衡常数如表:下列说法正确的是( )| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | 增加Fe2O3固体可以提高CO的转化率 | |
| B. | 减小容器体积既能提高反应速率又能提高平衡转化率 | |
| C. | 该反应的正反应△H<0 | |
| D. | 当容器内气体密度恒定时,不标志该反应已达到平衡状态 |
分析 A.增加Fe2O3固体,平衡不移动;
B.减小容器体积,反应速率加快,但平衡不移动;
C.由表格中数据可知,温度越高,K越小;
D.容器内气体密度恒定时,气体的质量、物质的量均不发生变化.
解答 解:A.增加Fe2O3固体,平衡不移动,则CP的转化率不变,故A错误;
B.减小容器体积,反应速率加快,但平衡不移动,则能提高反应速率,但不能提高平衡转化率,故B错误;
C.由表格中数据可知,温度越高,K越小,则升高温度平衡逆向移动,则△H<0,故C正确;
D.容器内气体密度恒定时,气体的质量、物质的量均不发生变化,则该反应已达到平衡状态,故D错误;
故选C.
点评 本题考查化学平衡,为高频考点,把握平衡移动、K的变化、平衡状态判定为解答的关键,侧重分析与应用能力的考查,注意表格数据的应用,选项A为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.在密闭容器中发生下列反应 aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
| A. | A的转化率变小 | B. | 平衡向正反应方向移动 | ||
| C. | D的物质的量变多 | D. | a>c+d |
12.下列化学用语表示正确的是( )
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | 乙烯的电子式: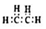 | |
| C. | 硫离子结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
9.下列有关物质性质的说法正确的是( )
| A. | 乙醇在铜催化加热下可制得乙醚 | |
| B. | 淀粉在稀硫酸催化加热下可制得氨基酸 | |
| C. | 苯和乙烯在一定条件下反应可制得乙苯 | |
| D. | 乙苯与酸性高锰酸钾溶液反应生成苯乙酸 |
16.pH=1的溶液中,能大量共存的一组离子是( )
| A. | Na+、NH4+、Cl-、SO42- | B. | Na+、Ba2+、Cl-、CO32- | ||
| C. | K+、Fe2+、SO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
6. 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:
由此回答以下问题:
(1)Y元素在周期表中的位置是第二周期ⅤA族,其单质的电子式是 .
.
(2)W最低价氢化物的水溶液呈弱酸性,其原因用化学用语解释是H2S?H++HS-.
(3)X、Y、Z组成的某种盐的水溶液pH<7,其原因用化学用语解释是NH4++H2O?NH3•H2O+H+,在该溶液中各种离子浓度的大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
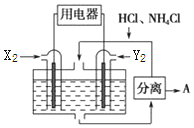
(4)用适当催化剂及电极材料,以HCl一NH4Cl为电解质溶液,构成如图所示的新型电池.
Ⅰ.该电池的正极反应式是N2+8H++6e-=2NH4+.
Ⅱ.分离出物质A的化学式是NH4Cl.
 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:| 元素 | 信息 |
| X | 原子半径最小 |
| Y | 单质在空气中含量最高 |
| Z | 其最外层电子数是电子层数的3倍 |
| W | 最高正价与最低负价的代数和为4 |
(1)Y元素在周期表中的位置是第二周期ⅤA族,其单质的电子式是
 .
.(2)W最低价氢化物的水溶液呈弱酸性,其原因用化学用语解释是H2S?H++HS-.
(3)X、Y、Z组成的某种盐的水溶液pH<7,其原因用化学用语解释是NH4++H2O?NH3•H2O+H+,在该溶液中各种离子浓度的大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(4)用适当催化剂及电极材料,以HCl一NH4Cl为电解质溶液,构成如图所示的新型电池.
Ⅰ.该电池的正极反应式是N2+8H++6e-=2NH4+.
Ⅱ.分离出物质A的化学式是NH4Cl.
13.下列有关物质的性质与用途不对应的是( )
| A. | 铝合金的密度小,硬度大,可用作建筑材料 | |
| B. | 食品工业用Na2CO3作焙制糕点的膨松剂 | |
| C. | FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板 | |
| D. | 明矾能生成Al(OH)3胶体,可用作净水剂 |