题目内容
16.pH=1的溶液中,能大量共存的一组离子是( )| A. | Na+、NH4+、Cl-、SO42- | B. | Na+、Ba2+、Cl-、CO32- | ||
| C. | K+、Fe2+、SO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
分析 pH=1的溶液,显酸性,根据离子之间不能结合生成沉淀、气体、水等,不能发生络离子反应,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.酸溶液中该组离子之间不反应,可大量共存,故A选;
B.Ba2+、CO32-结合生成沉淀,酸溶液中不能大量存在CO32-,不能共存,故B不选;
C.酸溶液中发生Fe2+、SO32-均与NO3-氧化还原反应,不能共存,故C不选;
D.Fe3+、SCN-结合生成络离子,不能共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的应用,题目难度不大.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
6.下列过程既是氧化还原反应,又是吸热反应的是( )
| A. | Na2O2溶于水 | B. | Ba(OH)2•8H2O与NH4Cl(s)混合并搅拌 | ||
| C. | 灼热的炭与CO2反应 | D. | 铝热反应 |
7.二氧化硫的含量是空气质量监测的一个重要指标.
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验.
①测得该雨水样品的pH为4.73;
②每隔1h,通过pH计测定雨水样品的pH,测得的结果如表:
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为大气中的CO2溶于雨水.
(2)分析上述数据变化,你认为形成这一变化的原因是H2SO3与空气中的O2作用转化为H2SO4,使雨水的酸性增强,pH减小.
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Br2+H2O=2HBr+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g.
(1)过滤时,除去沉淀中附着的过量氧化钡的方法是在漏斗中用蒸馏水淋洗.
(2)计算该空气样品中二氧化硫的体积分数(写出计算过程)
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验.
①测得该雨水样品的pH为4.73;
②每隔1h,通过pH计测定雨水样品的pH,测得的结果如表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(1)正常雨水的pH为5.6,偏酸性,这是因为大气中的CO2溶于雨水.
(2)分析上述数据变化,你认为形成这一变化的原因是H2SO3与空气中的O2作用转化为H2SO4,使雨水的酸性增强,pH减小.
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Br2+H2O=2HBr+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g.
(1)过滤时,除去沉淀中附着的过量氧化钡的方法是在漏斗中用蒸馏水淋洗.
(2)计算该空气样品中二氧化硫的体积分数(写出计算过程)
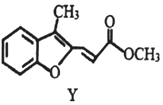
11.合成药物异搏定路线中某一步骤如下: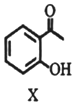 →
→ 下列说法不正确的是( )
下列说法不正确的是( )
 →
→ 下列说法不正确的是( )
下列说法不正确的是( )| A. | 物质X的分子式为C8H8O2 | |
| B. | 物质X中所有碳原子可能在同一平面内 | |
| C. | 物质Y的1H核磁共振谱图中有8组特征峰 | |
| D. | 1molY最多可与6mol氢气发生加成反应 |
1.高炉炼铁的主要反应为:3CO(g)+Fe2O3(s)?3CO2(g)+2Fe(s),已知该反应在不同温度下的平衡常数如表:下列说法正确的是( )
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | 增加Fe2O3固体可以提高CO的转化率 | |
| B. | 减小容器体积既能提高反应速率又能提高平衡转化率 | |
| C. | 该反应的正反应△H<0 | |
| D. | 当容器内气体密度恒定时,不标志该反应已达到平衡状态 |
8.某学习小组探究铝粉与硝酸钠溶液在不同环境下的反应,进行了如下实验,根据实验过程回答相关问题:
(1)实验一
①初始未见明显现象的原因用离子方程式解释是6H++Al2O3═2Al3++3H2O.
②液面上方呈浅红棕色的原因用化学方程式解释是2NO+O2=2NO2.
③若步骤ⅲ按以下反应式发生,请完成该反应的离子方程式:I-+NO2=NO3-+NO↑+I2
(2)实验二
①步骤i中产生气泡的化学式是H2.
②步骤ⅱ中产生有刺激性气味气体的电子式是 .
.
③步骤ⅱ反应的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(3)从实验一、二说明,NO3?在酸性环境中具有氧化性,在碱性环境中具有强氧化性.
(1)实验一
| 装置 | 步骤 | 现象 |
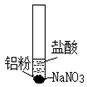 | ⅰ.取少量铝粉于试管,并加入盐酸 | 初始未见明显现象,一段时间后,冒出无色气泡. |
| ⅱ.在试管加入硝酸钠固体 | 继续冒出气泡,液面上方呈浅棕色,试管逐渐变热至沸腾. | |
| ⅲ.用湿润KI-淀粉试纸靠近试管口 | KI-淀粉试纸变蓝色. |
②液面上方呈浅红棕色的原因用化学方程式解释是2NO+O2=2NO2.
③若步骤ⅲ按以下反应式发生,请完成该反应的离子方程式:I-+NO2=NO3-+NO↑+I2
(2)实验二
| 装置 | 步骤 | 现象 |
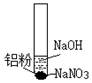 | ⅰ.取少量铝粉于试管,并加入氢氧化钠溶液 | 初始未见明显现象,一段时间后,冒无色气泡. |
| ⅱ.向试管中加入硝酸钠固体 | 继续冒出无色气泡,并有刺激性气味产生 | |
| ⅲ.用湿润红色石蕊试纸靠近试管口 | 试纸变蓝 | |
②步骤ⅱ中产生有刺激性气味气体的电子式是
 .
.③步骤ⅱ反应的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(3)从实验一、二说明,NO3?在酸性环境中具有氧化性,在碱性环境中具有强氧化性.
5.已知桶烯的结构简式为 ,有关桶烯的说法不正确的是( )
,有关桶烯的说法不正确的是( )
 ,有关桶烯的说法不正确的是( )
,有关桶烯的说法不正确的是( )| A. | 不慎将桶烯洒到地面瓷砖上,可用火烤干 | |
| B. | 桶烯在一定条件下能与3molBr2发生加成反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯分子中所有的碳原子一定不在同一个平面 |
20.下列反应的离子方程式书写正确的是( )
| A. | CuCl2溶液与 Fe 的反应:Cu2++Fe═Cu+Fe3+ | |
| B. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| C. | 氢氧化铝溶液与盐酸的反应:OH-+H+=H2O | |
| D. | 水垢中的CaCO3用CH3COOH溶液除去:CaCO3+2H+═Ca2++H2O+CO2↑ |