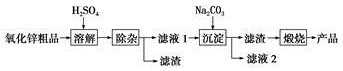
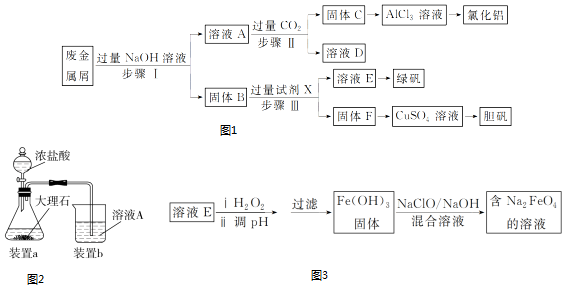
题目内容
19.下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是( )| A. | 能与NaOH溶液反应的同分异构体共有6种 | |
| B. | 存在分子中含有六元环的同分异构体 | |
| C. | 既含有羟基又含有醛基的有5种 | |
| D. | 不存在含有2个羟基的同分异构体 |
分析 A.分子式为C4H8O2的有机物,该有机物能与NaOH溶液反应,则可能是羧酸、也可能是酯;
B.分子式为C4H8O2的六元环: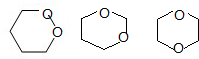 ;
;
C.C4H8O2属于羟基醛时,可以根据官能团的位置异构得到其同分异构体;
D.分子式为C4H8O2的有机物可以含有C=C和2个-OH.
解答 解:A.对于羧酸而言,根据羧基位置异构可以得到两种丁酸;根据酯基位置异构和碳链异构可得:甲酸丙酯2种(丙基2种异构)、乙酸乙酯1种、丙酸甲酯1种,共6种,故A正确;
B.分子式为C4H8O2的六元环: ,所以存在分子中含有六元环的同分异构体,故B正确;
,所以存在分子中含有六元环的同分异构体,故B正确;
C.C4H8O2属于羟基醛时,可以是2-羟基丁醛、3-羟基丁醛、4-羟基丁醛、2-甲基-2-羟基丙醛、2-甲基-3羟基丙醛,共5种同分异构体,故C正确;
D.分子式为C4H8O2的有机物可以含有C=C和2个-OH,其结构简式为:CH2(OH)CH(OH)CH=CH2,故D错误.
故选D.
点评 本题考查同分异构体的种类,根据官能团异构和位置异构和碳链异构来综合分析同分异构体的种数,难度不大,有利于培养学生的逻辑推理能力.

练习册系列答案
相关题目
2.关于下列几种物质的原料或用途叙述正确的是( )
| A. | 玻璃是透明的属于晶体 | B. | 二氧化硅是制造光导纤维的材料 | ||
| C. | 石灰石是制造陶瓷的主要原料 | D. | 纯碱是制取水泥的主要原料 |
10.某溶液只可能含有下列离子中的几种:K+、NH4+、SO42-、AlO2-、NO3-(不考虑水的电离).取200mL该溶液,分为等体积的两份,分别做下列两个实验.实验1:向第一份溶液中加入足量的烧碱并加热,在标准状况下产生的气体体积为224mL.实验2:向第二份溶液中加入足量的BaCl2溶液,生成沉淀2.33g,下列说法正确的是( )
| A. | 该溶液中可能含有K+ | |
| B. | 该溶液中肯定含有NH4+、SO42-、AlO2-、NO3- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含K+,且c(K+)≥0.1 mol•L-1 |
7.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
14.分子式为C8H8O2的有机物,结构中含有苯环且能够发生水解反应的同分异构体(不考虑立体结构)有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$
(2)下列各项中,不能够说明该反应已达到平衡的是bd
a.恒温、恒容条件下,容器内的压强不发生变化
b.恒温、恒容条件下,容器内的气体密度不发生变化
c.一定条件下,CO、H2和CH3CH的浓度保持不变
d.一定条件下,单位时间内生成1mol H2,同时生成1mol CH3OH
e.混合气体的平均相对分子质量不再变化
(3)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①若容器容积不变,可增加甲醇产率的措施是降低温度或及时分离甲醇.
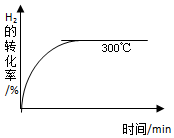
②其他条件相同时,在上述三个温度下分别发生该反应.300℃时,H2的转化率随时间的变化如图所示,请补充完成250℃时H2的转化率随时间的变化示意图.
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则 CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$ kJ•mol-1.
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$
(2)下列各项中,不能够说明该反应已达到平衡的是bd
a.恒温、恒容条件下,容器内的压强不发生变化
b.恒温、恒容条件下,容器内的气体密度不发生变化
c.一定条件下,CO、H2和CH3CH的浓度保持不变
d.一定条件下,单位时间内生成1mol H2,同时生成1mol CH3OH
e.混合气体的平均相对分子质量不再变化
(3)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②其他条件相同时,在上述三个温度下分别发生该反应.300℃时,H2的转化率随时间的变化如图所示,请补充完成250℃时H2的转化率随时间的变化示意图.
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则 CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$ kJ•mol-1.