题目内容
18.某烃A不能使溴水褪色,最简式是CH,0.1mol A完全燃烧时生成13.44L二氧化碳(标准状况).(1)A的结构简式为
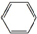 .
.(2)根据下列条件写出有关反应的化学方程式并指明反应类型:
①A与浓硫酸和浓硝酸的混合液反应生成B;
 ,取代反应.
,取代反应.②在催化剂作用下A与H2反应生成C.
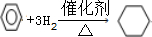 ,加成反应.
,加成反应.
分析 n(CO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,即0.1mol A完全燃烧时生成0.6mol二氧化碳,由C原子守恒可知,A中含6个C,A的最简式是CH,则A为C6H6,以此来解答.
解答 解:n(CO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,即0.1mol A完全燃烧时生成0.6mol二氧化碳,由C原子守恒可知,A中含6个C,A的最简式是CH,则A为C6H6,
(1)烃A不能使溴水褪色,则A为苯,结构简式为 ,
,
故答案为: ;
;
(2)①A与浓硫酸和浓硝酸的混合液反应生成B,反应方程式为 ,属于取代反应,
,属于取代反应,
故答案为: ;取代;
;取代;
②苯和足量氢气在一定条件下发生加成反应生成环己烷,反应的方程式为 ,属于加成反应,
,属于加成反应,
故答案为: ;加成.
;加成.
点评 本题考查有机物的推断及结构与性质,为高频考点,把握原子守恒、最简式推断有机物为解答的关键,侧重分析与应用能力的考查,注意苯的结构与性质,题目难度不大.

练习册系列答案
相关题目
8.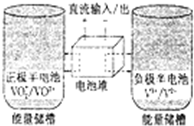 全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
 全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )| A. | 放电时,右槽发生还原反应 | |
| B. | 放电时,左槽的电极反应式:VO2++2H++e-═VO2++H2O | |
| C. | 充电时,每转移1mol电子,n(H+)的变化量为1mol | |
| D. | 充电时,阴极电解液pH升高 |
9.次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.NaH2PO2为正盐,可将溶液中的Ag+还原为Ag,从而可用于化学镀银.利用NaH2PO2进行化学镀银反应中,若氧化剂与还原剂的物质的量之比为4:1,则氧化产物的化学式为( )
| A. | H3PO4 | B. | Na3PO4 | C. | Ag | D. | Na2HPO2 |
6.下列物质中,属于酸性氧化物但不溶于水的是( )
| A. | 二氧化硫 | B. | 二氧化氮 | C. | 二氧化硅 | D. | 二氧化碳 |
13.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )
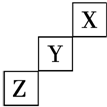

| A. | Z可能是活泼金属元素 | |
| B. | X的最高价氧化物对应的水化物是一种强酸 | |
| C. | Y元素原子的最外层电子数为7 | |
| D. | Z的最高价氧化物对应水化物的化学式为H2ZO4 |
7.下列有关实验的说法正确的是( )
| A. | 将少量SO2通入氨水和硝酸钡的混合溶液中产生白色沉淀,说明NO3-将SO2氧化生成了硫酸钡 | |
| B. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| C. | 为除去乙酸乙酯中混有的少量乙酸杂质,可向混合溶液中加入适量的乙醇并加热 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
8.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
| A. | AlCl3 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 高锰酸钾 |
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.