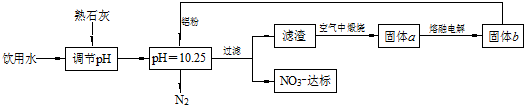
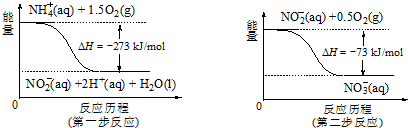题目内容
15.(1)在a、b两支试管中,分别装上形态相同、质量相等的一颗锌粒,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸(酸过量),填写下列空白:?a、b两支试管中的现象:相同点是都产生无色气泡;不同点是a中反应速率较快,原因是盐酸是强酸,醋酸是弱酸,盐酸溶液中c(H+)大.
?a、b两支试管中反应完毕后生成气体的总体积是V(a)等于V(b)(填“大于”、“小于”或“等于”);原因是酸过量,产生氢气的量由锌决定,锌的质量相等.
(2)现有常温下的0.1mol•L-1纯碱溶液.
?你认为该溶液呈碱性的原因是(用两个离子方程式表示):CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-.
?为证明你的上述观点,请设计一个简单的实验,简述实验过程:向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点.
③同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32- 离子不超过其总量的10%.请你设计实验证明该同学的观点是否正确:用pH试纸(或pH计)测常温下0.1mol•L-1纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确.
分析 (1)观察到都有无色的气体产生,但氢离子的浓度不同,所以反应速率不等;
酸过量,生成氢气的量取决于锌的量;
(2)①碳酸根离子部分水解,导致溶液呈碱性,据此写出水解的离子方程式;
②可向滴有酚酞的碳酸钠溶液中滴入氯化钙溶液,若溶液红色逐渐变浅并最终消失则证明该观点;
③用pH试纸测定0.1mol/L的碳酸钠溶液的pH,若pH<12,则说明发生水解的CO32-离子不超过其总量的10%.
解答 解:(1)盐酸是强酸,醋酸是弱酸,相同物质的量浓度、相同体积的稀盐酸和稀醋酸,盐酸中氢离子浓度大于醋酸,两只试管中观察到都有产生无色的气体,但因为盐酸中氢离子的浓度大于醋酸,所以a中产生氢气的速率比b快;
由于酸过量,产生氢气的量由锌决定,锌的质量相等,则生成氢气的体积相等,
故答案为:都产生无色气泡;a中反应速率较快;盐酸是强酸,醋酸是弱酸,盐酸溶液中c(H+)大;等于;酸过量,产生氢气的量由锌决定,锌的质量相等;
(2)①碳酸根离子在溶液中发生水解反应:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,导致溶液显示碱性,
故答案为:CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;
②证明纯碱溶液显示碱性是碳酸根离子水解导致的方法为:向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点,
故答案为:向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点;
③Na2CO3的水解是微弱的,发生水解的CO32- 离子不超过其总量的10%,证明方法为:用pH试纸(或pH计)测常温下0.1 mol•L-1纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确,
故答案为:用pH试纸(或pH计)测常温下0.1 mol•L-1纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确.
点评 本题考查了弱电解质的电离平衡、盐的水解原理及其影响,题目难度中等,明确影响电离平衡、盐的水解的因素为解答关键,(2)为难点,注意掌握性质实验方案设计的原则,试题培养了学生的分析、理解能力及化学实验能力.

| A. | CH2=CH-CH=CH2 | B. | CH≡C-CH=CH2 | C. |  | D. |  |
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度均降低 | |
| B. | SO2能使品红溶液和溴水均褪色 | |
| C. | 氯水和浓硝酸均要盛装在棕色试剂瓶中 | |
| D. | NaCl固体中混有NH4Cl或I2,均可用加热法除去 |
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 食盐溶液能导电,所以它是电解质 | |
| C. | NaHSO4无论在水溶液里还是在熔融状态下都可以电离出Na+、H+和SO42- | |
| D. | SO3的水溶液可以导电,但它不是电解质 |
| A. | 1 mol Cl2与足量NaOH反应,转移的电子数为NA | |
| B. | 常温常压下,11.2 L甲烷中含有的氢原子数小于2 NA | |
| C. | 1 mol碳烯(:CH2)所含的电子数目为6 NA | |
| D. | T℃时,1 L pH=6的纯水中含OH-数为10-6NA |
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ②③④ |