题目内容
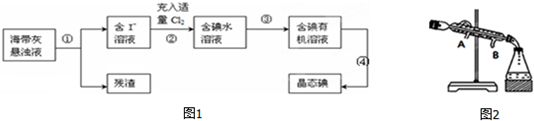
12.某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了如图1探究:
请回答下列问题:
Ⅰ实验时用10mol•L-1的浓硫酸配制100mL 1mol•L-1 H2SO4溶液,
(1)需用量筒量取10.0mL上述浓硫酸进行配制.
(2)所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀硫酸时,还缺少的玻璃仪器是容量瓶,该仪器所具备的功能是A (填序号).
A.配制一定体积准确浓度的溶液
B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体
D.用来溶解固体溶质
(3)在图2配制过程示意图中,错误的有(填序号)①④.
(4)下列操作导致所配制的稀硫酸的物质的量浓度偏低的是AEFH (填字母).
A、用量筒量取浓硫酸时俯视凹液面
B、将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶
C、容量瓶用蒸馏水洗后未干燥
D、定容时仰视液面
E、未洗涤烧杯和玻璃棒
F、转移到容量瓶的过程中,有少量的溶液溅出
G、用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中
H、用不干燥的量筒量取浓硫酸
Ⅱ(1)步骤③中产生的红褐色物质是(填化学式)Fe(OH)3.
(2)从红褐色的悬浊液到得到固体最后的称量,一系列过程中所需的基本操作为:
a.过滤,b.洗涤,c.灼烧,d.冷却.
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为0.19ag.
(4)写出步骤②的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
分析 Ⅰ.(1)根据浓硫酸在稀释前后,溶质的物质的量保持不变进行计算;
(2)配制一定物质的量浓度的溶液需要容量瓶,容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(3)稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视;
(4)根据公式c=$\frac{n}{V}$,可以根据影响n和V的因素来分析回答;
Ⅱ.由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量,
(1)步骤③是将Fe3+转化为氢氧化铁沉淀;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(3)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算;
(4)在酸性条件下亚铁离子被双氧水氧化成铁离子.
解答 解:Ⅰ.(1)浓硫酸在稀释前后,溶质的物质的量保持不变,设所需浓硫酸最小体积为V,则100mL×10-3×1mol/L=10mol/L×V,解得V=10.0mL,
故答案为:10.0;
(2)配制一定物质的量浓度的溶液需要容量瓶,容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,
故答案为:容量瓶;A;
(3)稀释浓硫酸时是将浓硫酸沿器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视,不能仰视和俯视,
故答案为:①④;
(4)A、用量筒量取浓硫酸时俯视凹液面,所取浓硫酸偏少,故稀硫酸的物质的量浓度偏低;
B、将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,溶液体积偏小,故稀硫酸的物质的量浓度偏高;
C、容量瓶用蒸馏水洗后未干燥,对稀硫酸的物质的量浓度没有影响;
D、定容时仰视液面,溶液体积偏小,故稀硫酸的物质的量浓度偏高;
E、未洗涤烧杯和玻璃棒,所取浓硫酸偏少,故稀硫酸的物质的量浓度偏低;
F、转移到容量瓶的过程中,有少量的溶液溅出,溶质偏少了,故稀硫酸的物质的量浓度偏低;
G、用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中,所取浓硫酸偏高,故稀硫酸的物质的量浓度偏高;
H、用不干燥的量筒量取浓硫酸,浓硫酸的量偏少,故稀硫酸的物质的量浓度偏低;
故选:AEFH;
Ⅱ.(1)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,则该红褐色物质为Fe(OH)3,
故答案为:Fe(OH)3;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;
(3)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量:$\frac{ag×\frac{112}{160}}{10}$=0.07ag,含硫酸亚铁的质量为:$\frac{\frac{0.07a}{56}}{152}$=0.19ag,
故答案为:0.19a;
(4)在酸性条件下亚铁离子被双氧水氧化成铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
点评 本题考查学生对物质的量浓度溶液的配制实验原理与实验操作的理解、化学计算等知识,题目难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | 2g | B. | 4g | C. | 8g | D. | 10g |

| A. | 曲线a是使用了催化剂的能量变化曲线 | |
| B. | 反应物的总键能高于生成物的总键能 | |
| C. | 反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)△H=+115.6 kJ/mol | |
| D. | 若反应生成2 mol 液态水,放出的热量高于115.6 kJ |
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105 Pa,32gO2所含原子数为NA | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,44gCO2含有的分子数为NA |
| A. | 分子中含有碳元素和氢元素的化合物是烃类 | |
| B. | 相对分子质量相同的物质一定是同种物质 | |
| C. | 相对分子质量相差14的两种有机物,一定是属于同系物 | |
| D. | 分子式相同结构不同的有机物一定是同分异构体 |
| A. | 食盐用于制纯碱 | B. | 硅藻土作吸咐剂 | ||
| C. | 用硫酸铜配制农药 | D. | 乙二醇作医用消毒剂 |
| A. | ④①②③ | B. | ④②①③ | C. | ②④①③ | D. | ④①③② |