题目内容
17.超细氮化铝粉末被广泛应用于大规模集成电路生产等领域.其制取原理为:Al2O3+N2+3C$\stackrel{高温}{→}$2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质.为测定该产品中有关成分的含量,进行了以下两个实验:(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况).
①上述反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑;
②该样品中的A1N的质量分数为61.5%.
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g•L-1(已折算成标准状况,AIN不跟O2反应).该样品中含杂质炭1.92g.
分析 (1)①由题目信息可知,由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,据此配平书写反应方程式;
②根据氮元素守恒计算10g样品中含有AlN的物质的量,根据m=nM计算AlN的质量,再根据质量分数定义计算;
(2)气体产物的平均摩尔质量=1.34g•L-1×22.4L/mol=30g/mol,氧气不足,生成气体是CO和CO2混合气体,计算二者物质的量之比,再根据氧原子守恒计算CO和CO2的物质的量,根据碳元素守恒计算碳的质量.
解答 解:(1)①由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,其反应方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
②生成NH3的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,根据氮元素守恒可知10g样品中含有AlN的物质的量为0.15mol,质量为0.15mol×41g/mol=6.15g,该样品中的AlN的质量分数为$\frac{6.15g}{10g}$×100%=61.5%,
故答案为:61.5%;
(2)气体产物的平均摩尔质量=1.34g•L-1×22.4L/mol=30g/mol,氧气不足,生成气体是CO和CO2混合气体,CO与CO2的物质的量之比为(44-30):(30-28)=7:1,氧气的物质的量为$\frac{2.016L}{22.4L/mol}$=0.09mol,设CO2为y mol,由氧原子守恒:7y+2y=0.09×2,解得x=0.02,故碳元素质量为(0.02mol+0.02mol×7)×12g/mol=1.92g,
故答案为:1.92.
点评 本题考查混合物计算,难度中等,侧重考查学生分析计算能力,注意利用守恒思想进行的计算.

 阅读快车系列答案
阅读快车系列答案| A. | 3He原子中的质子在原子核外空间内一定轨道上绕核做高速运动 | |
| B. | 3He原子不是微小的实心球体 | |
| C. | 3He原子是不能再分的微粒 | |
| D. | 3He的最外层电子数为2,易与其他物质发生化学反应 |
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
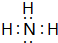 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).
| A. | AlCl3,H2SO4,KOH | B. | BaCl2,NaOH,KHCO3 | ||
| C. | AgNO3,HNO3,NaBr | D. | FeCl3,HNO3,Ca(OH)2 |
| A. | HCO3-+H2O?CO2↑+H2O+OH- | B. | HS-+H2O?H3O++S2- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | CO32-+H2O?HCO3-+OH- |
| A. | 1.0×10-4 mol/L | B. | 1.0×10-8 mol/L | ||
| C. | 1.0×10-11 mol/L | D. | 1.0×10-10 mol/L |
