题目内容
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105 Pa,32gO2所含原子数为NA | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,44gCO2含有的分子数为NA |
分析 A、氦气为单原子分子;
B、求出氧气的物质的量,然后根据1mol氧气中含2mol氧原子来分析;
C、标况下,水为液体;
D、根据分子数N=$\frac{m}{M}{N}_{A}$来计算.
解答 解:A、氦气为单原子分子,故含NA个氦原子的氦气为1mol,在标况下为22.4L,故A错误;
B、32g氧气的物质的量为1mol,而氧气为双原子分子,故1mol氧气中含2mol氧原子即2NA个,故B错误;
C、标况下,水为液体,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、44g二氧化碳中含有的分子数N=$\frac{m}{M}{N}_{A}$=$\frac{44g}{44g/mol}{N}_{A}$=NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
10.机动车尾气排放的氮的氧化物,是城市空气污染源之一,其中一种含氮元素的质量分数为46.7%,它是( )
| A. | N2O | B. | NO2 | C. | NO | D. | N2O5 |
11.下列与金属腐蚀有关的说法正确的是( )


| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,一段时间后会出现白色沉淀-灰绿色沉淀-红褐色沉淀的现象 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
15.表是几种常见弱酸的电离平衡常数(25℃).
回答下列各题?
(1)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系是:相同条件下K值越大,电离出的氢离子浓度越大,酸性越强.
(2)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,?其中酸性最强的是H3PO4?,最弱的是HS-.
(3)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,即K1》K2》K3,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(4)某温度(T℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,则
①该温度下水的Kw=1×10-13.
②该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,所得溶液为中性.(填“酸性”、“中性”或“碱性”)
(5)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
.
①NaOH溶液滴定CH3COOH溶液的曲线是图2(填“图1”或“图2”);
②a=20.00mL.
③该实验操作所需的主要玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶.
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.75×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系是:相同条件下K值越大,电离出的氢离子浓度越大,酸性越强.
(2)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,?其中酸性最强的是H3PO4?,最弱的是HS-.
(3)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,即K1》K2》K3,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(4)某温度(T℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,则
①该温度下水的Kw=1×10-13.
②该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,所得溶液为中性.(填“酸性”、“中性”或“碱性”)
(5)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
.

①NaOH溶液滴定CH3COOH溶液的曲线是图2(填“图1”或“图2”);
②a=20.00mL.
③该实验操作所需的主要玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶.
5.表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素的单质中熔点最高的可能是碳(填元素名称).
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为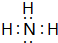 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.
(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
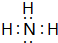 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).
