题目内容
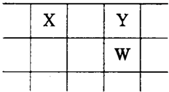
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、Y的氢化物沸点较高是因为其相对分子质量比较大 |
| B、W的最高价氧化物对应水化物的酸性比Z的强 |
| C、Z的非金属性比Y的强 |
| D、X与Y形成的化合物中既有离子键又有共价键 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W均为短周期元素,由元素的位置可知,X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是内层电子数的3倍,Y原子最外层电子数为6,所以Y为O元素,可推知X为N元素,Z为S元素,W为Cl元素,
A.水分子之间存在氢键,沸点高于硫化氢;
B.同周期随原子序数增大,元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
C.同主族自上而下非金属性减弱;
D.X与Y形成的常见化合物属于共价化合物.
A.水分子之间存在氢键,沸点高于硫化氢;
B.同周期随原子序数增大,元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
C.同主族自上而下非金属性减弱;
D.X与Y形成的常见化合物属于共价化合物.
解答:
解:X、Y、Z、W均为短周期元素,由元素的位置可知,X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是内层电子数的3倍,Y原子最外层电子数为6,所以Y为O元素,可推知X为N元素,Z为S元素,W为Cl元素,
A.水分子之间存在氢键,沸点高于硫化氢,故A错误;
B.非金属性W>Z,故最高价氧化物对应水化物的酸性W>Z,故B正确;
C.同主族自上而下非金属性减弱,非金属性Y>Z,故C错误;
D.X与Y形成的常见化合物属于共价化合物,不含离子键,故D错误,
故选B.
A.水分子之间存在氢键,沸点高于硫化氢,故A错误;
B.非金属性W>Z,故最高价氧化物对应水化物的酸性W>Z,故B正确;
C.同主族自上而下非金属性减弱,非金属性Y>Z,故C错误;
D.X与Y形成的常见化合物属于共价化合物,不含离子键,故D错误,
故选B.
点评:本题考查结构性质位置关系应用,侧重对元素周期表与元素周期律的考查,难度不大,注意掌握元素周期律,理解同主族、同周期元素性质的递变规律.

练习册系列答案
相关题目
下列物质只能作还原剂的是( )
| A、Fe |
| B、Fe2+ |
| C、Fe3+ |
| D、H+ |
下列事实不能说明一元酸HA是弱酸的是( )
| A、中和一定的NaOH溶液,需消耗与NaOH等物质的量的HA |
| B、将pH=4的HA溶液稀释10倍,溶液pH小于5 |
| C、将pH=2的HA溶液与pH=12的NaOH溶液等体积混合后,溶液呈酸性 |
| D、将0.1mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,溶液呈碱性 |
有一处于平衡状态的反应:X(s)+3Y(g)?3Z(g),△H<0,为了使平衡向生成Z的方向移动,应选择的条件是( )
①加入X②低温③高压④低压⑤加催化剂⑥分离出Z.
①加入X②低温③高压④低压⑤加催化剂⑥分离出Z.
| A、①③⑤ | B、②③⑤ |
| C、②⑥ | D、②④⑥ |
下列装置所示的实验中,能达到实验目的是( )
A、 分离碘和酒精 |
B、 除去Cl2中的HCl |
C、 排水法收集NO |
D、 配制硫酸溶液 |
一定条件下,向一带活塞的密闭容器中充入1molN2和3molH2,发生下列反应:N2(g)+3H2(g)?2NH3(g),反应达到平衡后,改变下述条件,达到平衡后NH3的物质的量浓度不改变的是( )
| A、保持温度和容器压强不变,充入1molNH3(g) |
| B、保持温度和容器体积不变,充入1molNH3(g) |
| C、保持温度和容器体积不变,充入1molN2(g) |
| D、保持温度和容器体积不变,充入1molAr(g) |
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )| A、五种元素中,X最难形成离子化合物 |
| B、五种元素中,Q的最高价含氧酸的酸性强 |
| C、Y的简单阴离子比W的简单阴离子还原性强 |
| D、Z与Q形成的化合物水溶液一定显酸性 |