题目内容
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,15 g甲基(-CH3)所含的电子数为7NA |
| B、水的摩尔质量就是NA个水分子的质量之和 |
| C、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D、1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量,结合甲基是中性原子团计算电子数;
B、摩尔质量是以g/mol为单位,数值上等于NA个水分子的质量之和;
C、钠离子物质的量为1mol,Na2O2溶于1L水中反应生成氢氧化钠和氧气,溶于体积不是1L;
D、依据镁原子最外层电子为2个,结合镁全部反应分析计算.
| m |
| M |
B、摩尔质量是以g/mol为单位,数值上等于NA个水分子的质量之和;
C、钠离子物质的量为1mol,Na2O2溶于1L水中反应生成氢氧化钠和氧气,溶于体积不是1L;
D、依据镁原子最外层电子为2个,结合镁全部反应分析计算.
解答:
解:A、依据n=
计算物质的量=
=1mol,结合甲基是中性原子团计算电子数=1mol×9×NA=9NA,故A错误;
B、摩尔质量是以g/mol为单位,数值上等于NA个水分子的质量之和,摩尔质量和质量单位不同,故B错误;
C、钠离子物质的量为1mol,Na2O2溶于1L水中反应生成氢氧化钠和氧气,溶于体积不是1L,Na+的物质的量浓度大于1mol/L,故C错误;
D、依据镁原子最外层电子为2个,结合镁全部反应分析计算,1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子,故D正确;
故选D.
| m |
| M |
| 15g |
| 15g/mol |
B、摩尔质量是以g/mol为单位,数值上等于NA个水分子的质量之和,摩尔质量和质量单位不同,故B错误;
C、钠离子物质的量为1mol,Na2O2溶于1L水中反应生成氢氧化钠和氧气,溶于体积不是1L,Na+的物质的量浓度大于1mol/L,故C错误;
D、依据镁原子最外层电子为2个,结合镁全部反应分析计算,1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是物质的量和物理量的计算应用,反应过程分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,48gO3含有的氧原子数为3NA |
| B、1.8g的NH4+离子中含有的电子数为0.1NA |
| C、非标准状况下,22.4 L O2中含有的氧气分子数也可能约为6.02×1023 |
| D、2.4g金属镁变为镁离子时失去的电子数为0.1NA |
下列装置所示的实验中,能达到实验目的是( )
A、 分离碘和酒精 |
B、 除去Cl2中的HCl |
C、 排水法收集NO |
D、 配制硫酸溶液 |
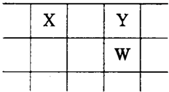 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )| A、五种元素中,X最难形成离子化合物 |
| B、五种元素中,Q的最高价含氧酸的酸性强 |
| C、Y的简单阴离子比W的简单阴离子还原性强 |
| D、Z与Q形成的化合物水溶液一定显酸性 |
常温时,下列关于电解质溶液的叙述正确的是( )
| A、稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B、pH均为5的盐酸和硫酸氢钠溶液中,水的电离程度相同 |
| C、等物质的量浓度的①NH4HSO4②NH4Cl ③CH3COONH4④(NH4)2SO4c(NH4+)的大小顺序是 ①②③④ |
| D、分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
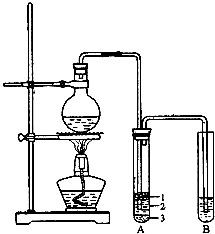 实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空: