题目内容
2.已知:H2O(g)═H2O(l)△H=Q1KJ•mol-1C2H5OH(g)═C2H5OH(l)△H=Q2KJ•mol-1
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3KJ•mol-1
则反应C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=( ) KJ•mol-1.
| A. | Q3-Q2+3 Q1 | B. | Q3+Q2+Q1 | C. | 3Q3-Q2+Q1 | D. | Q2-Q3+3 Q1 |
分析 由于一个反应无论是一步完成还是分为数步完成,只要是始态和终态相同,反应的热效应即相同,让所给的反应经过加减乘除等变形,得到所给的目标反应,反应热也做相应的变化即可.
解答 解:已知:①H2O(g)═H2O(l)△H=Q1KJ•mol-1
②C2H5OH(g)═C2H5OH(l)△H=Q2KJ•mol-1
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3KJ•mol-1
将③-②+3×①可得:反应C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)故反应的△H=Q3-Q2+3 Q1,故选A.
点评 本题考查了盖斯定律的运用,难度不大,应注意基础的掌握和解题思路的选择.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.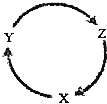 下列各组物质中,不能满足如图物质一步转化关系的选项是( )
下列各组物质中,不能满足如图物质一步转化关系的选项是( )
 下列各组物质中,不能满足如图物质一步转化关系的选项是( )
下列各组物质中,不能满足如图物质一步转化关系的选项是( ) | 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Al(OH)3 | AlCl3 | Al2O3 |
| C | SiO2 | Na2SiO3 | H2SiO3 |
| D | NH3 | NH4Cl | NH4NO3 |
| A. | A | B. | B | C. | C | D. | D |
17.下列溶液一定是碱性的是( )
| A. | 溶液中含有OH- | B. | 滴加甲基橙后溶液显红色 | ||
| C. | 溶液中c(OH-)>c(H+) | D. | 滴加甲基橙后溶液显黄色 |
11.将0.2mol•L-1HCOOH溶液加水稀释,下列说法正确的是( )
| A. | 溶液中c(H+)和c(OH-)都减小 | B. | 溶液中c(H+)增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液的pH增大 |
12.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L | |
| C. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1mol Zn,转移的电子总数等于2NA | |
| D. | 5.4g Al分别与含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA |

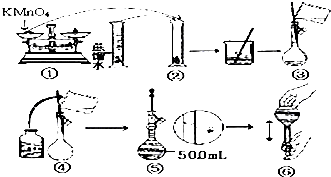 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度: