题目内容
20.取一定质量的Cu、Cu2O、CuO的固体混合物,将其分成两等份.其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L.已知Cu2O+2H+═Cu+Cu2++H2O.则稀硝酸的浓度为( )| A. | 2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.4 mol•L-1 |
分析 一份用足量的氢气还原,反应后固体质量为Cu的质量,另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,根据Cu元素守恒可知:n[Cu(NO3)2]=n(Cu),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],再根据c=$\frac{n}{V}$计算硝酸的浓度.
解答 解:一份用足量的氢气还原,反应后固体质量为Cu的质量,故n(Cu)=$\frac{25.6g}{64g/mol}$=0.4mol,
另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,根据Cu元素守恒可知:n[Cu(NO3)2]=n(Cu)=0.4mol,根据氮元素守恒可知:n(HNO3)=n(NO)+2n[Cu(NO3)2]=$\frac{4.48L}{22.4L/mol}$+2×0.4mol=1mol,
所以该稀硝酸的浓度为:c(HNO3)=$\frac{1mol}{0.5L}$=2mol/L,
故选A.
点评 本题考查混合物反应的计算,题目难度中等,明确反应过程是解题的关键,注意利用守恒法进行解答,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
12.下列实验操作中错误的是( )
| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
9.高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.下图是用高炉烟尘制取硫酸锌的工业流程.
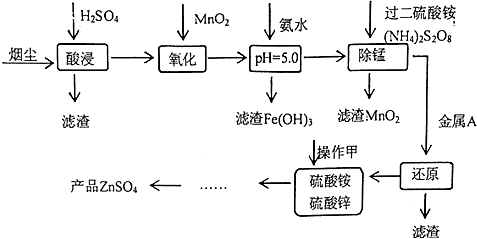
已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
②过二硫酸铵是一种强氧化剂.
③ZnSO4+4NH3═[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)升高温度.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计.
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(5)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C
A.锌粉 B.氨水 C.( NH4)2CO3 D.NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值10-1.6mol/L.

已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3═[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)升高温度.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计.
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(5)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C
A.锌粉 B.氨水 C.( NH4)2CO3 D.NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值10-1.6mol/L.
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程: 的不饱和度均为1,现有结构简式为
的不饱和度均为1,现有结构简式为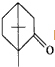 的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )
的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )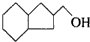

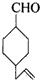
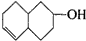
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.