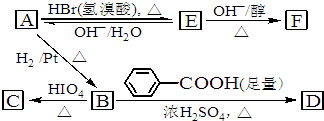
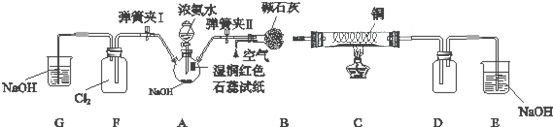
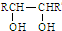题目内容
甲醇碱性燃料电池的总反应为:2CH3OH+4OH-+3O2=2CO32-+6H2O,请写出正、负极电极反应式.负极: ,正极: .
考点:电极反应和电池反应方程式,化学电源新型电池
专题:电化学专题
分析:甲醇碱性燃料电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,据此书写电极反应式.
解答:
解:甲醇碱性燃料电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O,正极上氧气得电子和水反应生成氢氧根离子,正极反应式为3O2+12H2O+12e-=12OH-,故答案为:2CH3OH-12e-+16OH-=2CO32-+12H2O;3O2+12H2O+12e-=12OH-.
点评:本题考查电极反应式的书写,知道燃料电池中负极上燃料发生氧化反应、正极上氧化剂发生还原反应,书写电极反应式要结合电解质溶液酸碱性,题目难度中等.

练习册系列答案
相关题目
分别取下列溶液各2毫升,用水稀释到20毫升,溶液的pH 由3.0变成4.0,则该溶液是( )
(a)一元强酸(b)二元弱酸(c)一元弱酸(d)二元强酸.
(a)一元强酸(b)二元弱酸(c)一元弱酸(d)二元强酸.
| A、(a) | B、(b) |
| C、(a)(c) | D、(a)(d) |
下列化学用语或模型正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、甲烷分子的比例模型: |
C、羟基的电子式: |
| D、葡萄糖的最简式:C6H12O6 |
不能用于区别稀硫酸和浓硫酸的方法的是( )
| A、加水溶解,观察溶液温度变化 |
| B、取相同质量敞口放置,过一段时间在称量,比较质量变化 |
| C、取相同量,加入到氯化钡溶液中,观察是否有沉淀产生 |
| D、取相同量于试管中,加入铜片,加热观察,是否有刺激性气味的气体产生 |
实验室用NaCl固体配500mL 1.0mol/LNaCl溶液,下列判断不对的是( )
| A、用托盘天平称取NaCl固体29.25g |
| B、应选用500 mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |