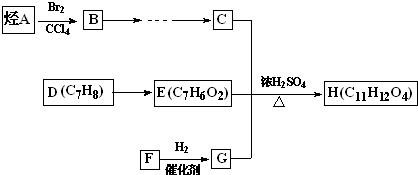
题目内容
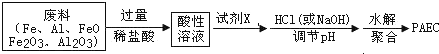
某实验小组用废铁屑(含少量铁锈等杂质)来制铁红.实验过程如下:先将废铁屑清洗干净,并加工成粉末.
铁粉
悬浊液
滤液
溶液
沉淀
铁红
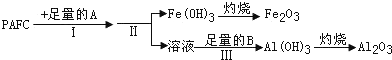
(1)铁红的化学式为 ;操作a和操作b (填“相同”或“不同”).
(2)步骤⑤中用到的仪器有三脚架、泥三角、玻璃棒、坩埚钳、 和
(3)步骤③反应产物中加入几滴KSCN,溶液会变红,请写出步骤③的离子方程式 .
(4)步骤④的离子方程式为 .
(5)检验步骤④加入氨水后沉淀是否完全的方法是 .
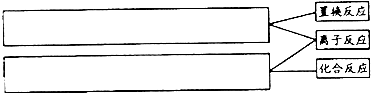
(6)将卜述过程中满足下列分类条件的反应的离子方程式填入相应方框.
(7)有人建议取消步骤③,你认为 (填“合理”或“不合理”),理由是 .
铁粉
| ① |
| 过量稀硫酸 |
| ②操作a |
| ③双氧水 |
| H+ |
| ④氨水 |
| 操作b |
| ⑤灼烧 |
(1)铁红的化学式为
(2)步骤⑤中用到的仪器有三脚架、泥三角、玻璃棒、坩埚钳、
(3)步骤③反应产物中加入几滴KSCN,溶液会变红,请写出步骤③的离子方程式
(4)步骤④的离子方程式为
(5)检验步骤④加入氨水后沉淀是否完全的方法是
(6)将卜述过程中满足下列分类条件的反应的离子方程式填入相应方框.

(7)有人建议取消步骤③,你认为
考点:铁的化学性质,金属的回收与环境、资源保护
专题:实验设计题
分析:(1)三氧化二铁为红棕色固体;操作a和操作b目的都是分离固体和液体;
(2)依据沉淀灼烧用到的仪器:酒精灯,三脚架,玻璃棒,坩埚,坩埚钳,泥三角;
(3)双氧水在酸性环境下能够氧化二价铁离子生成三价铁离子;
(4)三价铁离子与一水合氨反应生成氢氧化铁沉淀;
(5)如果三价铁离子沉淀不完全,则取上层清液,加入KSCN,溶液呈现红色;
(6)依据制备过程中发生的化学反应,结合置换反应、离子反应、化合反应的概念解答;
(7)氢氧化亚铁不稳定容易被空气中的氧气氧化生成氢氧化铁.
(2)依据沉淀灼烧用到的仪器:酒精灯,三脚架,玻璃棒,坩埚,坩埚钳,泥三角;
(3)双氧水在酸性环境下能够氧化二价铁离子生成三价铁离子;
(4)三价铁离子与一水合氨反应生成氢氧化铁沉淀;
(5)如果三价铁离子沉淀不完全,则取上层清液,加入KSCN,溶液呈现红色;
(6)依据制备过程中发生的化学反应,结合置换反应、离子反应、化合反应的概念解答;
(7)氢氧化亚铁不稳定容易被空气中的氧气氧化生成氢氧化铁.
解答:
解:(1)三氧化二铁为红棕色固体,化学式为:Fe2O3;操作a和操作b目的都是分离固体和液体;都是过滤,所以二者相同;
故答案为:Fe2O3;相同;
(2)沉淀灼烧用到的仪器:酒精灯,三脚架,玻璃棒,坩埚,坩埚钳,泥三角;
故答案为:酒精灯;坩埚;
(3)双氧水在酸性环境下能够氧化二价铁离子生成三价铁离子,离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)三价铁离子与一水合氨反应生成氢氧化铁沉淀,离子方程式为:Fe3++3NH3?H20=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3?H20=Fe(OH)3↓+3NH4+;
(5)取上层清液,加入KSCN,溶液呈现红色,则三家铁离子沉淀不完全,若不出现红色,可证明三价铁离子沉淀完全;
故答案为:取上层清液放入试管,加入几滴KSCN,观察溶液盐酸是否变血红色;
(6)该过程中依次发生的反应:Fe+2H+=Fe2++H2↑;Fe2O3+6H+=2Fe3++3H2O;2Fe2++H2O2+2H+=2Fe3++2H2O;2Fe3++3OH-=Fe(OH)3↓;2Fe(OH)3
Fe2O3+3H2O;
属于离子反应的有:Fe+2H+=Fe2++H2↑;Fe2O3+6H+=2Fe3++3H2O;Fe+2Fe3+=3Fe2+;2Fe2++H2O2+2H+=2Fe3++2H2O;
属于置换反应的有:Fe+2H+=Fe2++H2↑;
属于化合反应的有:Fe+2Fe3+=3Fe2+;
故答案为: ;
;
(7)氢氧化亚铁不稳定容易被空气中的氧气氧化生成氢氧化铁,所以不需要进行步骤③,故答案为:合理;氢氧化亚铁不稳定容易被空气中的氧气氧化生成氢氧化铁.
故答案为:Fe2O3;相同;
(2)沉淀灼烧用到的仪器:酒精灯,三脚架,玻璃棒,坩埚,坩埚钳,泥三角;
故答案为:酒精灯;坩埚;
(3)双氧水在酸性环境下能够氧化二价铁离子生成三价铁离子,离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)三价铁离子与一水合氨反应生成氢氧化铁沉淀,离子方程式为:Fe3++3NH3?H20=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3?H20=Fe(OH)3↓+3NH4+;
(5)取上层清液,加入KSCN,溶液呈现红色,则三家铁离子沉淀不完全,若不出现红色,可证明三价铁离子沉淀完全;
故答案为:取上层清液放入试管,加入几滴KSCN,观察溶液盐酸是否变血红色;
(6)该过程中依次发生的反应:Fe+2H+=Fe2++H2↑;Fe2O3+6H+=2Fe3++3H2O;2Fe2++H2O2+2H+=2Fe3++2H2O;2Fe3++3OH-=Fe(OH)3↓;2Fe(OH)3
| ||
属于离子反应的有:Fe+2H+=Fe2++H2↑;Fe2O3+6H+=2Fe3++3H2O;Fe+2Fe3+=3Fe2+;2Fe2++H2O2+2H+=2Fe3++2H2O;
属于置换反应的有:Fe+2H+=Fe2++H2↑;
属于化合反应的有:Fe+2Fe3+=3Fe2+;
故答案为:
 ;
; (7)氢氧化亚铁不稳定容易被空气中的氧气氧化生成氢氧化铁,所以不需要进行步骤③,故答案为:合理;氢氧化亚铁不稳定容易被空气中的氧气氧化生成氢氧化铁.
点评:本题考查了三氧化二铁的制备,熟悉铁及其化合物的性质是解题关键,题目难度中等.

练习册系列答案
相关题目
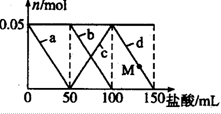 向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)2↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、原混合溶液中CO32-与Al2-的物质的量之比为1:1 |
| D、M点时,溶液中沉淀的质量为3.9g |
下述实验能达到预期目的是( )
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
下列实验装置或操作能达到实验目的( )
A、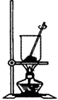 将海带灼烧成灰 |
B、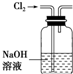 除去Cl2中混有的HCl气体 |
C、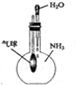 验证NH3易溶于水 |
D、 蒸干NH4Cl饱和溶液制备NH4Cl 晶体 |
X、Y、Z、W有如如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y不可能是( )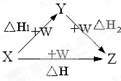

| A、C、CO |
| B、AlCl3、Al(OH)3 |
| C、Fe、Fe(NO3)2 |
| D、S、SO3 |