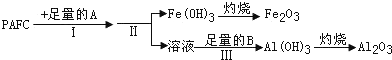
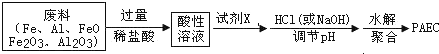
题目内容
某学习小组为研究低价态氮元素物质的还原性,以NH3为例设计了如图实验(夹持设备略去)
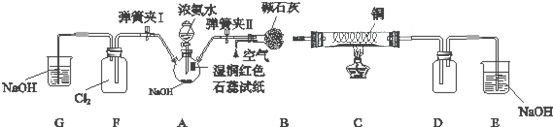
Ⅰ.检验气密性后关闭弹簧夹I打开弹簧夹Ⅱ,点燃酒精灯,铜丝红热后打开分液漏斗的活塞,A中气体进入B中时不断通入空气,反应一段时间后熄灭酒精灯.
Ⅱ.当D中有明显现象时关闭弹簧夹Ⅱ;打开弹簧夹Ⅰ
(1)能证明有氨气产生的现象是 ;氨分子电子式为 .
(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为 热反应(填“吸热”或“放热”NH3在C中反应的化学方程式为 .
(3)D中产生红棕色气体和白烟,产生白烟的化学方程式为
(4)F中也产生大量白烟,写出该反应中反应物的物质的量之比n(NH3):n(Cl2)=
(5)用化学方程式及相应理论说明A中能产生大量NH3气体的原因 ,比较某时刻A中分液漏斗溶液平衡常数K1和三颈瓶中溶液的平衡常数K2大小关系,K1 K2(填“<”“=”“>”).
(6)装置中A稍有不足,应该怎样改进 .

Ⅰ.检验气密性后关闭弹簧夹I打开弹簧夹Ⅱ,点燃酒精灯,铜丝红热后打开分液漏斗的活塞,A中气体进入B中时不断通入空气,反应一段时间后熄灭酒精灯.
Ⅱ.当D中有明显现象时关闭弹簧夹Ⅱ;打开弹簧夹Ⅰ
(1)能证明有氨气产生的现象是
(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为
(3)D中产生红棕色气体和白烟,产生白烟的化学方程式为
(4)F中也产生大量白烟,写出该反应中反应物的物质的量之比n(NH3):n(Cl2)=
(5)用化学方程式及相应理论说明A中能产生大量NH3气体的原因
(6)装置中A稍有不足,应该怎样改进
考点:性质实验方案的设计
专题:实验设计题
分析:(1)氨气能使湿润的红色石蕊试纸变蓝,氨气是共价化合物,原子间以共用电子对形成化学键;
(2)在催化剂、加热条件下,氨气被氧气氧化生成一氧化氮和水,氨气和氧化铜反应生成铜、氮气和水;
(3)一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸和氨气反应生成硝酸铵;
(4)白烟是氯化铵,根据转移电子守恒计算n(NH3):n(Cl2);
(5)氢氧根离子抑制铵根离子的水解,且温度越高,越促进氨气生成;
(6)氨气的量增大,导致压强增大,易产生安全事故.
(2)在催化剂、加热条件下,氨气被氧气氧化生成一氧化氮和水,氨气和氧化铜反应生成铜、氮气和水;
(3)一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸和氨气反应生成硝酸铵;
(4)白烟是氯化铵,根据转移电子守恒计算n(NH3):n(Cl2);
(5)氢氧根离子抑制铵根离子的水解,且温度越高,越促进氨气生成;
(6)氨气的量增大,导致压强增大,易产生安全事故.
解答:
解:(1)氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使溶液呈碱性,碱遇红色石蕊试纸变蓝,所以能证明有氨气产生的现象是A中湿润的红色石蕊试纸变蓝,氨气分子的电子式为 ,故答案为:A中湿润的红色石蕊试纸变蓝;
,故答案为:A中湿润的红色石蕊试纸变蓝; ;
;
(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为放热反应,放出的热量使铜丝仍保持红热,在催化剂、加热条件下,氨气被氧气氧化生成一氧化氮和水,氨气和氧化铜反应生成铜、氮气和水,反应方程式为4NH3+5O2
4NO+6H2O,2NH3+3CuO
3Cu+N2+3H2O,
故答案为:放;4NH3+5O2
4NO+6H2O,2NH3+3CuO
3Cu+N2+3H2O;
(3)NO和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸和氨气反应生成硝酸铵,白烟是固体硝酸铵小颗粒,反应方程式为:HNO3+NH3=NH4NO3,
故答案为:HNO3+NH3=NH4NO3;
(4)白烟是氯化铵,氯气和氨气反应生成氯化铵和氮气,根据转移电子守恒得该反应方程式为:8NH3+3Cl2=6NH4Cl+N2,该反应中反应物的物质的量之比n(NH3):n(Cl2)=8:3,故答案为:8:3;
(5)NH3+H2O?NH3.H2O?NH4++OH-△H<0,该反应是放热反应,氢氧化钠溶解后使溶液中氢氧根离子浓度增大,平衡向逆反应方向移动,同时氢氧化钠溶解时放出热量,也使平衡向逆反应方向移动,产生大量氨气,温度越高,平衡常数越小,所以K1>K2,
故答案为:NH3+H2O?NH3.H2O?NH4++OH-△H<0,氢氧化钠使c(OH-)增大,平衡逆向移动,同时氢氧化钠溶于水放出大量热,也使平衡逆向移动,产生大量氨气;>;(6)氨气的量增大,导致压强增大,易产生安全事故,为防止产生氨气事故,装置中A装置分液漏斗与三颈瓶之间增加一气压平衡管,故答案为:装置中A装置分液漏斗与三颈瓶之间增加一气压平衡管.
 ,故答案为:A中湿润的红色石蕊试纸变蓝;
,故答案为:A中湿润的红色石蕊试纸变蓝; ;
; (2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为放热反应,放出的热量使铜丝仍保持红热,在催化剂、加热条件下,氨气被氧气氧化生成一氧化氮和水,氨气和氧化铜反应生成铜、氮气和水,反应方程式为4NH3+5O2
| ||
| △ |
| ||
| △ |
故答案为:放;4NH3+5O2
| ||
| △ |
| ||
| △ |
(3)NO和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸和氨气反应生成硝酸铵,白烟是固体硝酸铵小颗粒,反应方程式为:HNO3+NH3=NH4NO3,
故答案为:HNO3+NH3=NH4NO3;
(4)白烟是氯化铵,氯气和氨气反应生成氯化铵和氮气,根据转移电子守恒得该反应方程式为:8NH3+3Cl2=6NH4Cl+N2,该反应中反应物的物质的量之比n(NH3):n(Cl2)=8:3,故答案为:8:3;
(5)NH3+H2O?NH3.H2O?NH4++OH-△H<0,该反应是放热反应,氢氧化钠溶解后使溶液中氢氧根离子浓度增大,平衡向逆反应方向移动,同时氢氧化钠溶解时放出热量,也使平衡向逆反应方向移动,产生大量氨气,温度越高,平衡常数越小,所以K1>K2,
故答案为:NH3+H2O?NH3.H2O?NH4++OH-△H<0,氢氧化钠使c(OH-)增大,平衡逆向移动,同时氢氧化钠溶于水放出大量热,也使平衡逆向移动,产生大量氨气;>;(6)氨气的量增大,导致压强增大,易产生安全事故,为防止产生氨气事故,装置中A装置分液漏斗与三颈瓶之间增加一气压平衡管,故答案为:装置中A装置分液漏斗与三颈瓶之间增加一气压平衡管.
点评:本题考查物质的性质、实验探究等知识点,综合性较强,难点是(4)题,会根据转移电子数相等进行计算,难度中等.

练习册系列答案
相关题目
溶度积常数(Ksp)是表示判断物质性质的重要常数,下列说法中,正确的是( )
| A、饱和石灰水中加入一定量的生石灰,温度明显升高,Ksp减少 |
| B、向CaCl2 溶液中通入CO2气体不能产生沉淀,是因为c(Ca2+ )?c(CO32-)>Ksp(CaCO3) |
| C、向BaCl2 溶液中加入等量的同浓度的 Na2CO3 和Na2SO4 溶液先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D、Ksp小的物质的溶解能力一定比Ksp大的物质小 |
下述实验能达到预期目的是( )
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
下列实验装置或操作能达到实验目的( )
A、 将海带灼烧成灰 |
B、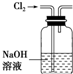 除去Cl2中混有的HCl气体 |
C、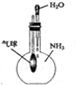 验证NH3易溶于水 |
D、 蒸干NH4Cl饱和溶液制备NH4Cl 晶体 |
将2.0molPCl3和2.0molCl2充入体积不变的1L密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g) 达到平衡时,PCl5为1.0mol;如果此时将PCl3和Cl2全部移走,在相同温度下再达平衡时PCl5的物质的量是( )
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |
下列依据相关实验得出的结论正确的是( )
| A、向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C、向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀.证明葡萄糖中不含醛基 |
| D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
下列图示与对应叙述相符合的是( )
A、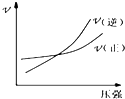 如图:反应N2+3H2?2NH3在恒温情况下,反应速率与压强的关系 |
B、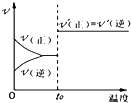 如图:反应H2+I2?2HI 达平衡后,升高温度时反应速率随时间的变化 |
C、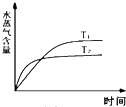 如图:反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
D、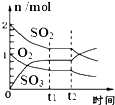 如图:反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |