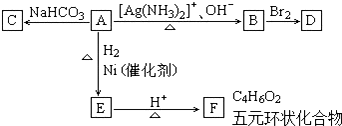题目内容
实验室用NaCl固体配500mL 1.0mol/LNaCl溶液,下列判断不对的是( )
| A、用托盘天平称取NaCl固体29.25g |
| B、应选用500 mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
考点:溶液的配制
专题:实验评价题
分析:A.托盘天平精确到0.1g;
B.只能配制一定体积的物质的量浓度溶液;
C.有少量液体溅出会导致溶质的物质的量偏小,配制溶液浓度偏低;
D.定容时用胶头滴管操作.
B.只能配制一定体积的物质的量浓度溶液;
C.有少量液体溅出会导致溶质的物质的量偏小,配制溶液浓度偏低;
D.定容时用胶头滴管操作.
解答:
解:A.托盘天平精确到0.1g,所以用托盘天平称取NaCl固体29.3g,故A错误;
B.常见容量瓶规格为100mL、200mL、500mL、1000mL等,配500mL溶液,故需选用500mL容量瓶来配制溶液,故B正确;
C.转移溶液时有少量液体溅出,导致配制的溶液中氢氧化钠的物质的量偏小,则最终溶液的浓度偏低,故需重新配制,故C正确;
D.定容时使用胶头滴管,防止加水超过刻度线,则加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容,故D正确;
故选A.
B.常见容量瓶规格为100mL、200mL、500mL、1000mL等,配500mL溶液,故需选用500mL容量瓶来配制溶液,故B正确;
C.转移溶液时有少量液体溅出,导致配制的溶液中氢氧化钠的物质的量偏小,则最终溶液的浓度偏低,故需重新配制,故C正确;
D.定容时使用胶头滴管,防止加水超过刻度线,则加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容,故D正确;
故选A.
点评:本题考查了配制一定物质的量浓度的溶液方法,题目难度中等,注意掌握配制一定物质的量浓度的溶液步骤及选用仪器的方法,要求学生熟悉常见的容量瓶规格.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列依据相关实验得出的结论正确的是( )
| A、向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C、向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀.证明葡萄糖中不含醛基 |
| D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
下列对有关实验事实的解释正确的是( )
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
X、Y、Z、W有如如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y不可能是( )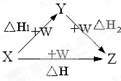

| A、C、CO |
| B、AlCl3、Al(OH)3 |
| C、Fe、Fe(NO3)2 |
| D、S、SO3 |
下列图示与对应叙述相符合的是( )
A、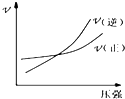 如图:反应N2+3H2?2NH3在恒温情况下,反应速率与压强的关系 |
B、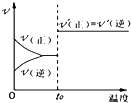 如图:反应H2+I2?2HI 达平衡后,升高温度时反应速率随时间的变化 |
C、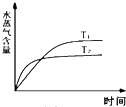 如图:反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
D、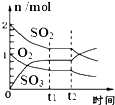 如图:反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |