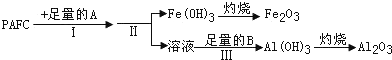
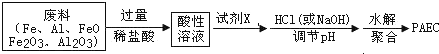
题目内容
分别取下列溶液各2毫升,用水稀释到20毫升,溶液的pH 由3.0变成4.0,则该溶液是( )
(a)一元强酸(b)二元弱酸(c)一元弱酸(d)二元强酸.
(a)一元强酸(b)二元弱酸(c)一元弱酸(d)二元强酸.
| A、(a) | B、(b) |
| C、(a)(c) | D、(a)(d) |
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:一元强酸、二元强酸都是强电解质,在水中完全电离,不存在电离平衡;
一元弱酸、二元弱酸都是弱电解质,在水中部分电离,存在电离平衡,加水稀释,促进弱酸的电离.
一元弱酸、二元弱酸都是弱电解质,在水中部分电离,存在电离平衡,加水稀释,促进弱酸的电离.
解答:
解:溶液2毫升,用水稀释到20毫升,溶液的pH 由3.0变成4.0,可知溶液稀释十倍,pH值增大为1,酸中的氢离子数量不随着溶液的稀释而变化.
强酸是强电解质,完全电离,不存在电离平衡,氢离子个数不随着溶液的稀释而变化,符合要求;
弱酸都是弱电解质,在水中部分电离,存在电离平衡,加水稀释,促进弱酸的电离,产生的氢离子数量增多,溶液稀释十倍,pH值增大值小于1,
故选:D.
强酸是强电解质,完全电离,不存在电离平衡,氢离子个数不随着溶液的稀释而变化,符合要求;
弱酸都是弱电解质,在水中部分电离,存在电离平衡,加水稀释,促进弱酸的电离,产生的氢离子数量增多,溶液稀释十倍,pH值增大值小于1,
故选:D.
点评:本题考查了溶液的稀释及pH值变化规律,明确强弱电解质电离特点是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
溶度积常数(Ksp)是表示判断物质性质的重要常数,下列说法中,正确的是( )
| A、饱和石灰水中加入一定量的生石灰,温度明显升高,Ksp减少 |
| B、向CaCl2 溶液中通入CO2气体不能产生沉淀,是因为c(Ca2+ )?c(CO32-)>Ksp(CaCO3) |
| C、向BaCl2 溶液中加入等量的同浓度的 Na2CO3 和Na2SO4 溶液先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D、Ksp小的物质的溶解能力一定比Ksp大的物质小 |
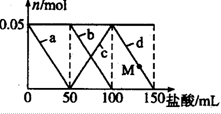 向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)2↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、原混合溶液中CO32-与Al2-的物质的量之比为1:1 |
| D、M点时,溶液中沉淀的质量为3.9g |